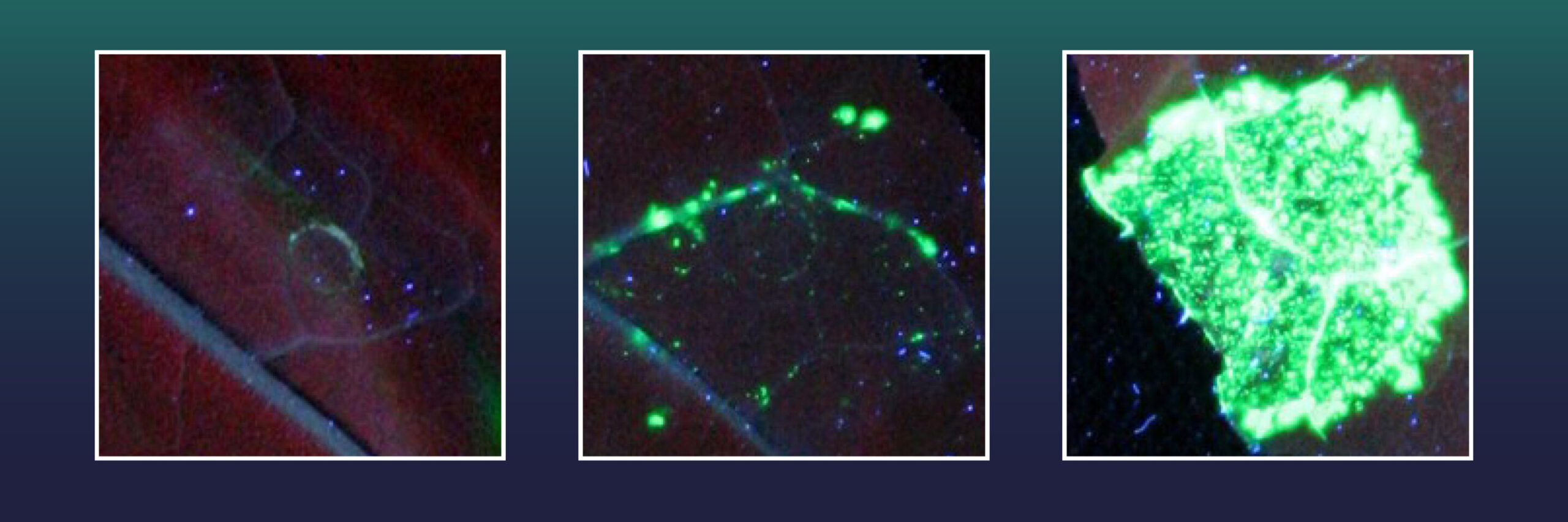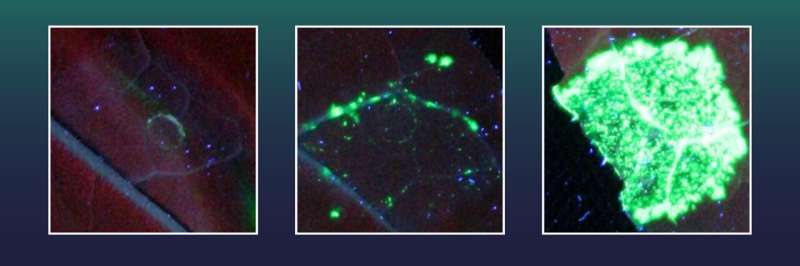
Jeder grün fluoreszierende Fleck stellt eine Blattzelle dar, in der ein großer genetischer Abschnitt erfolgreich in das Pflanzengenom eingefügt wurde. Es wurden verschiedene Cas9-Varianten verwendet: ein inaktives Cas9 (links), ein aktives Cas9 (Mitte) und ein Exonuklease-fusioniertes Cas9 (rechts). Bildnachweis: Tom Schreiber, IPB, Leibniz-Institut für Pflanzenbiochemie, IPB
Wissenschaftlern des Leibniz-Instituts für Pflanzenbiochemie (IPB) ist es erstmals gelungen, große genetische Abschnitte stabil und präzise in die DNA höherer Pflanzen einzubauen. Dazu optimierten sie die Gen-Editing-Methode CRISPR/Cas, allgemein bekannt als „genetische Schere“.
Die verbesserte CRISPR-Methode bietet große Möglichkeiten zur gezielten Genbearbeitung höherer Pflanzen, sowohl für die Züchtung als auch für die Forschung. Die von Professor Alain Tissier und Dr. Tom Schreiber geleitete Studie wurde in veröffentlicht Molekulare Pflanze.
CRISPR/Cas ist eine Methode mit enormem Potenzial zur gezielten Veränderung einzelner Gene. Dies gilt jedoch nicht für alle Arten genetischer Veränderungen, die Züchter und Wissenschaftler auf ihrer Wunschliste haben. Obwohl genetische Scheren ideal sind, um Gene auszuschalten, also vorhandene Gene auszuschalten oder zu entfernen, eignen sie sich nicht gut für das präzise Einfügen von Genen oder das Ersetzen von Gensegmenten. Für den gezielten Einbau von Genen in die DNA höherer Pflanzen erwiesen sich Genscheren bisher als zu ineffizient und daher wenig geeignet.
„Der Grund liegt im pflanzeninternen Mechanismus zur Reparatur von DNA-Brüchen“, sagt Schreiber. Diese Reparaturenzyme sind sofort vorhanden, sobald die DNA beschädigt ist. Sie erkennen auch die sanften Schnitte der Genschere und fügen die beiden durchtrennten DNA-Stränge der Doppelhelix sofort wieder zusammen. Dieses Anhaften der geschnittenen DNA erfolgt sehr schnell und ungenau; Es kommt zu geringfügigen Informationsverlusten, bei denen winzige Abschnitte der DNA verloren gehen oder hinzugefügt werden.
„Diese Ungenauigkeiten sind bei Knockout-Projekten kein Problem und sogar erwünscht“, erklärt Schreiber, „weil ich das Gen sowieso deaktivieren möchte. Wenn ich aber ein Gen einfügen möchte, muss das sehr genau erfolgen. Die genetische Information muss.“ Das Gen muss genau eingefügt werden, es darf keine Komponente fehlen und es dürfen keine zusätzlichen Komponenten integriert werden, sonst verliert das Gen seine Funktion und der ganze Versuch ist umsonst.
Aus diesem Grund gelang das präzise und narbenfreie Einfügen von Genen oder größeren DNA-Abschnitten, vermittelt durch CRISPR/Cas, bisher nur in seltenen Einzelfällen. Um die Erfolgsquote der Geneinfügung zu erhöhen, rüsteten die Hallenser Wissenschaftler die Genschere mit einem zusätzlichen Enzym namens Exonuklease aus.
Exonukleasen können die durch Genscheren erzeugten DNA-Schnittstellen so verändern, dass die zellinternen Reparaturenzyme DNA-Schäden nicht mehr erkennen und reparieren können. Der durch CRISPR/Cas einzufügende DNA-Abschnitt hätte somit dank eines weiteren sehr präzisen zellulären Reparaturmechanismus ausreichend Zeit, sich an der richtigen Position zu integrieren.
In dem Experiment testeten die Hallenser Wissenschaftler verschiedene Exonukleasen viralen, bakteriellen, pflanzlichen und menschlichen Ursprungs auf ihre Fähigkeit, die Anzahl präziser Geninsertionsereignisse zu erhöhen. Sie schleusten die Genschere mit den entsprechenden Exonukleasen und einem Abschnitt des X-Gens in die Blattzellen der Tabakpflanze Nicotiana benthamiana ein.
Diese Tabakzellen waren zuvor mit einem Gen für einen grünen Fluoreszenzmarker ausgestattet. Außerdem enthielten sie ein zerstörtes X-Gen, das für die Bildung des grünen Fluoreszenzfarbstoffs notwendig ist. Allerdings kann der Fluoreszenzmarker erst erzeugt werden, wenn ein Großteil der genetischen Information des X-Gens fehlt.
Der grüne Marker kann nur erzeugt werden, wenn der fehlende Genabschnitt einfach die Rate erfolgreicher Geninsertionsereignisse zählen kann. .
Zwei der getesteten Exonukleasen, darunter eine aus der Familie der Herpesviren, erwiesen sich als besonders wirksam. Dank dieser gelang Halles Team eine 38-mal perfektere Geneinfügung als mit CRISPR/Cas allein.
Dieser experimentelle Ansatz wurde dann mit anderen einzubauenden Genen und in anderen Pflanzen, nämlich Brunnenkresse (Arabidopsis thaliana) und Weizen, getestet. Da der Einbau des Gens in Tabakpflanzen nur lokal in den Blättern erfolgte, ging das integrierte Gen in der nächsten Tochtergeneration verloren und war somit nur für eine begrenzte Zeit im Genom vorhanden.
Deshalb versuchten Hallesche CRISPR-Experten bei Arabidopsis und Weizen, das Gen in Keimzellen einzubauen, um eine stabile Vererbung für künftige Pflanzengenerationen zu gewährleisten. Dank der getesteten Exonukleasen gelang eine stabile, also erbliche Inaktivierung von Genen bei Arabidopsis mit einer zehnfach höheren Häufigkeit und bei Weizen bei mehr als 1 % der Tochterpflanzen.
„Ein Prozent scheint zunächst nicht viel zu sein“, sagt Schreiber, „aber wenn ein Züchter seiner Pflanze eine bestimmte Eigenschaft hinzufügen möchte, muss er mit unserem optimierten CRISPR nur etwa 50 bis 100 Tochterpflanzen der ersten Generation auswählen.“ ./Fall, eine Pflanze mit der gewünschten Eigenschaft zu finden Dies würde im Vergleich zu herkömmlichen Züchtungsmethoden, bei denen 500 bis 1.000 Pflanzen zu diesem Zweck analysiert werden müssten, eine erhebliche Zeitersparnis bedeuten.
Die optimierte CRISPR/Cas-Methode stellt daher ein vielversprechendes Werkzeug für den gezielten Einbau von Genen in höhere Pflanzen und möglicherweise auch in andere Organismen dar. Künftig könnten Pflanzenzüchter mit dieser Methode beispielsweise verloren gegangene Resistenzgene gegen Krankheitserreger aus Wildarten oder alten Kultursorten wieder in moderne, ertragsstarke Elitesorten einführen. Auf diese Weise könnten solche wünschenswerten Eigenschaften die Pflanzenzüchtung verbessern und zur Entwicklung robusterer Nutzpflanzensorten beitragen.
Für die Wissenschaft bietet dieser Ansatz große Chancen, bestimmte Pflanzengene in einem einzigen Schritt elegant durch veränderte Kopien ihrer selbst zu ersetzen. Dies ist besonders nützlich für die Aufklärung der Genfunktion.
Mehr Informationen:
Tom Schreiber et al., Effektive narbenlose Multi-Kilobasen-Knock-ins in Pflanzen durch manipulierte CRISPR-Cas-Endonukleasen, Molekulare Pflanze (2024). DOI: 10.1016/j.molp.2024.03.013
Zur Verfügung gestellt vom Institut für Pflanzenbiochemie
Zitat: Verbesserte CRISPR-Methode ermöglicht stabile Insertion großer Gene in die DNA höherer Pflanzen (24. April 2024), abgerufen am 24. April 2024 von https://phys.org/news/2024-04-crispr-method-enables-stable- .html einfügen
Dieses Dokument unterliegt dem Urheberrecht. Mit Ausnahme der fairen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient lediglich der Information.