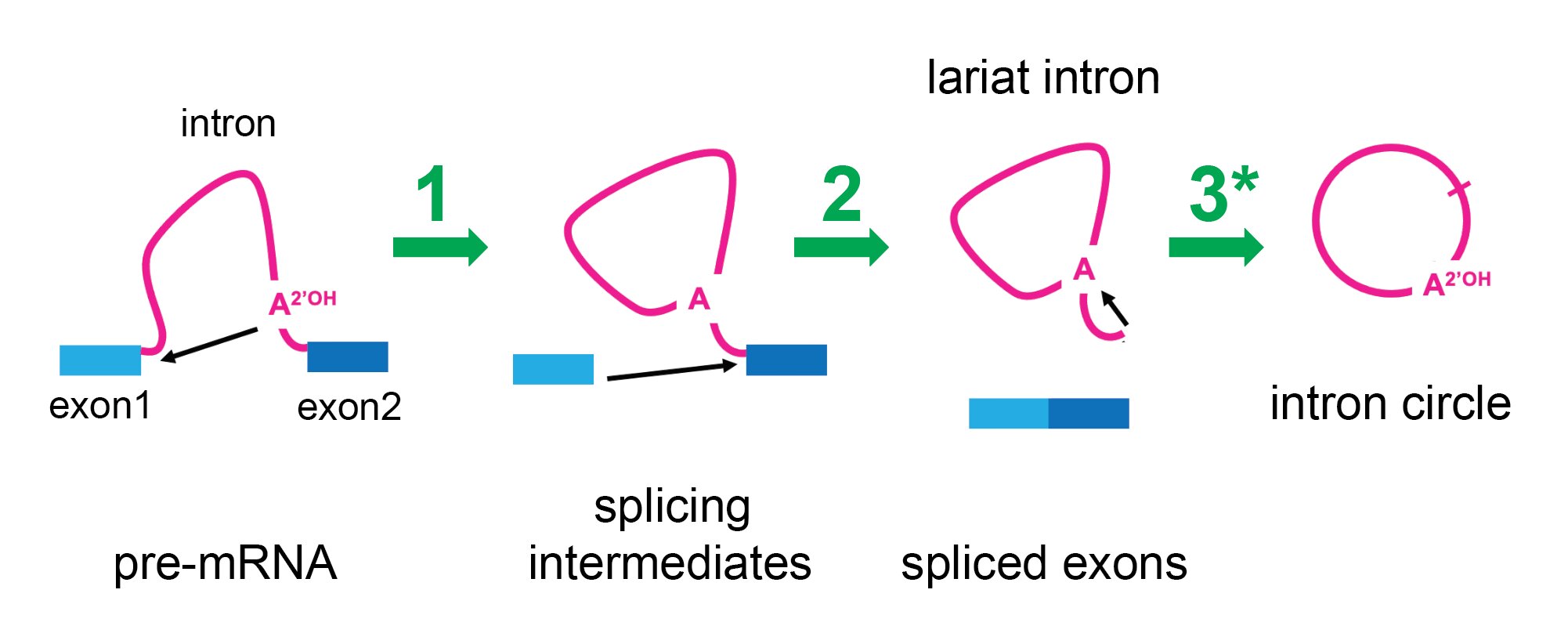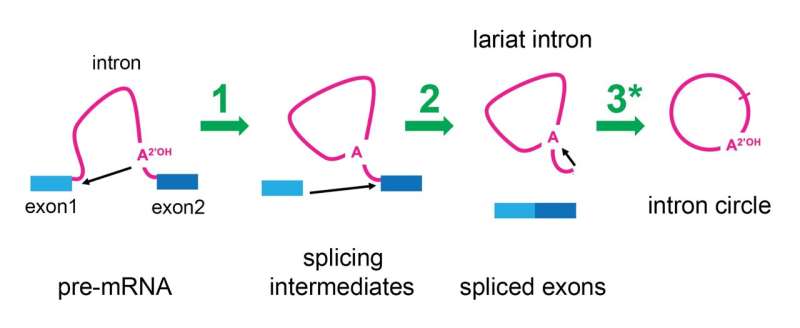
Der Spleißpfad wird angezeigt. Prä-Messenger-RNA (Prä-mRNA) besteht aus Exons (blau) und Introns (rosa). Es war bekannt, dass das Spleißosom (nicht gezeigt) zwei chemische Reaktionen (schwarze Pfeile) in einem zweistufigen Prozess (grüne Pfeile mit 1 und 2 markiert) katalysiert, die die Exons miteinander verschmelzen und das Intron wie ein Lasso entfernen. Diese Studie zeigt, dass das Spleißosom nach Abschluss des Spleißens immer noch aktiv ist und das Lariat-Intron mithilfe einer dritten Reaktion (grüner Pfeil 3), markiert mit einem Sternchen, in einen Kreis umwandeln kann. Bildnachweis: Manuel Ares, UC Santa Cruz
Auch wenn Sie sie nicht mögen oder noch nie davon gehört haben, sind in Ihrem Körper unzählige mikroskopisch kleine Maschinen namens Spleißosomen am Werk. Während Sie sitzen und lesen, setzen sie die fehlerhaften Informationen in Ihren Genen zuverlässig und schnell zusammen, indem sie Sequenzen namens „Introns“ entfernen, damit Ihre Boten-RNAs die richtigen Proteine herstellen können, die Ihre Zellen benötigen.
Introns sind vielleicht eines der größten Geheimnisse unseres Genoms. Hierbei handelt es sich um DNA-Sequenzen, die sensible proteinkodierende Informationen in Ihren Genen unterbrechen und „abgespalten“ werden müssen. Das menschliche Genom verfügt über Hunderttausende Introns, etwa 7 oder 8 pro Gen, und jedes wird durch einen speziellen RNA-Proteinkomplex namens „Spleißosom“ entfernt, der alle Introns herausschneidet und die verbleibenden kodierenden Sequenzen, sogenannte Exons, zusammensetzt. Es ist unklar, wie sich dieses kaputte Gensystem und das Spleißosom in unseren Genomen entwickelt haben.
Manny Ares, angesehener Professor für Molekular-, Zell- und Entwicklungsbiologie an der UC Santa Cruz, hat es sich im Laufe seiner langen Karriere zur Aufgabe gemacht, so viel wie möglich über das RNA-Spleißen zu lernen.
„Bei mir dreht sich alles um das Spleißosom“, sagte Ares. „Ich möchte einfach alles wissen, was das Spleißosom tut, auch wenn ich nicht weiß, warum es das tut.“
In einem neuen Artikel, der in der Zeitschrift veröffentlicht wurde Gene und EntwicklungAres berichtet von einer überraschenden Entdeckung über das Spleißosom, die uns mehr über die Evolution verschiedener Arten und darüber verraten könnte, wie sich Zellen an das seltsame Problem der Introns angepasst haben. Die Autoren zeigen, dass das Spleißosom, nachdem es die mRNA gespleißt hat, aktiv bleibt und weitere Reaktionen mit den entfernten Introns einleiten kann.
Dieser Befund ist der stärkste Hinweis, den wir bislang haben, dass Spleißosomen in der Lage sein könnten, ein Intron an einer anderen Stelle wieder in das Genom einzufügen. Dabei handelt es sich um eine Fähigkeit, von der bisher nicht angenommen wurde, dass sie Spleißosomen besitzen, sie ist jedoch ein gemeinsames Merkmal von „Gruppe-II-Introns“, entfernten Cousins des Spleißosoms, die hauptsächlich in Bakterien vorkommen.
Es wird angenommen, dass Spleißosom- und Gruppe-II-Introns einen gemeinsamen Vorfahren haben, der für die Ausbreitung von Introns im gesamten Genom verantwortlich war. Während sich Introns der Gruppe II jedoch von der RNA trennen und dann direkt wieder in die DNA zurückführen können, sind die „Spleißosom-Introns“ in den meisten Organismen höherer Ebenen zu finden erfordern das Spleißosom zum Spleißen und sollten nicht wieder in die DNA eingefügt werden. Erkenntnisse aus dem Ares-Labor deuten jedoch darauf hin, dass das Spleißosom auch heute noch Introns wieder in das Genom einfügen könnte. Dies ist eine interessante Möglichkeit, die in Betracht gezogen werden sollte, da Introns, die wieder in die DNA eingeführt werden, das Genom komplexer machen. Ein besseres Verständnis der Herkunft dieser Introns könnte uns helfen, besser zu verstehen, wie sich Organismen weiterentwickeln.
Bauen Sie auf einer interessanten Entdeckung auf
Die Gene eines Organismus bestehen aus DNA, in der vier Basen, Adenin (A), Cytosin (C), Guanin (G) und Thymin (T), in Sequenzen angeordnet sind, die biologische Anweisungen kodieren, beispielsweise wie man etwas herstellt spezifische Proteine im Körper. Bedürfnisse. Bevor diese Anweisungen gelesen werden können, wird DNA durch einen Prozess namens Transkription in RNA kopiert. Anschließend müssen die Introns dieser RNA entfernt werden, bevor ein Ribosom sie in tatsächliche Proteine übersetzen kann.
Das Spleißosom entfernt Introns mithilfe eines zweistufigen Prozesses, der dazu führt, dass ein Ende der RNA des Introns mit seiner Mitte verbunden wird und ein Kreis mit einem Schwanz entsteht, der einem „Lasso“ oder einem Cowboy-Lasso ähnelt. Dieses Erscheinungsbild hat dazu geführt, dass sie „Lariat-Introns“ genannt werden. Kürzlich machten Forscher der Brown University, die die Lage der Verbindungsstellen in diesen Lariaten untersuchten, eine seltsame Beobachtung: Einige Introns waren tatsächlich kreisförmig statt lariatförmig.
Diese Beobachtung erregte sofort Ares’ Aufmerksamkeit. Etwas schien mit den Lariat-Introns zu interagieren, nachdem sie aus der RNA-Sequenz entfernt wurden, um ihre Form zu ändern, und das Spleißosom war der Hauptverdächtige.
„Ich fand es aufgrund dieser alten, alten Vorstellung darüber, woher Introns kommen, interessant“, sagte Ares. „Es gibt zahlreiche Hinweise darauf, dass die RNA-Teile des Spleißosoms, snRNAs, eng mit Introns der Gruppe II verbunden sind.“
Da der chemische Mechanismus des Spleißens zwischen Spleißosomen und ihren entfernten Verwandten, den Introns der Gruppe II, sehr ähnlich ist, haben viele Forscher die Hypothese aufgestellt, dass sich Teile dieser Introns entwickelten, wenn der Selbstspleißprozess zu ineffizient wurde, als dass Introns der Gruppe II zuverlässig selbstständig terminieren könnten zum Spleißosom werden. Während Introns der Gruppe II in der Lage waren, sich direkt wieder in die DNA einzufügen, ging man davon aus, dass spliceosomale Introns, die die Unterstützung von Spleißosomen erforderten, nicht wieder in die DNA eingefügt werden konnten.
„Eine der Fragen, die mir in dieser Geschichte irgendwie gefehlt hat, war: Ist es möglich, dass das moderne Spleißosom immer noch in der Lage ist, ein Lariat-Intron aufzunehmen und es irgendwo im Genom einzufügen?“ sagte Ares. „Ist es immer noch in der Lage, das zu tun, was der Ahnenkomplex getan hat?“
Um mit der Beantwortung dieser Frage zu beginnen, beschloss Ares zu untersuchen, ob es tatsächlich das Spleißosom war, das Änderungen an den Lariat-Introns vornahm, um deren Schwänze zu entfernen. Sein Labor verlangsamte den Spleißprozess in Hefezellen und stellte fest, dass sich das Spleißosom, nachdem es die mRNA freigesetzt hatte, aus der es die Introns gespleißt hatte, an die Intron-Lariats klammerte und diese in echte Kreise umformte. Das Ares-Labor konnte veröffentlichte RNA-Sequenzierungsdaten aus menschlichen Zellen erneut analysieren und stellte fest, dass auch menschliche Spleißosomen über diese Fähigkeit verfügten.
„Wir freuen uns darüber, denn obwohl wir nicht wissen, was diese zirkuläre RNA bewirken könnte, deutet die Tatsache, dass das Spleißosom immer noch aktiv ist, darauf hin, dass es möglicherweise in der Lage ist, die Insertion des Lariat-Introns in das Genom zu katalysieren.“ .
Wenn das Spleißosom in der Lage ist, das Intron wieder in die DNA einzufügen, würde dies auch der Theorie, dass Spleißosomen und Gruppe-II-Introns lange Zeit einen gemeinsamen Vorfahren hatten, erhebliches Gewicht verleihen.
Testen Sie eine Theorie
Nachdem Ares und sein Labor nun gezeigt haben, dass das Spleißosom die katalytische Fähigkeit besitzt, hypothetisch Introns in die DNA zu verlagern, wie es ihre Vorfahren taten, besteht der nächste Schritt für die Forscher darin, eine künstliche Situation zu schaffen, in der sie einem DNA-Strang „füttern“. Spleißosom, das noch an einem Lariat-Intron befestigt ist, und sehen, ob sie es tatsächlich dazu bringen können, das Intron irgendwo einzufügen, was einen „Proof of Concept“ für diese Theorie darstellen würde.
Wenn das Spleißosom in der Lage ist, Introns wieder in das Genom einzufügen, wird dies beim Menschen wahrscheinlich ein sehr seltenes Ereignis sein, da die Nachfrage nach menschlichen Spleißosomen extrem hoch ist und daher nicht viel Zeit für die entfernten Introns bleibt. In anderen Organismen, in denen das Spleißosom jedoch nicht so stark ausgelastet ist, kann die Wiedereinfügung von Introns häufiger vorkommen. Ares arbeitet eng mit dem UCSC-Professor für Biomolekulartechnik Russ Corbett-Detig zusammen, der kürzlich eine systematische und umfassende Suche nach neuen Introns in den verfügbaren Genomen aller intronhaltigen Arten durchgeführt hat, die in der Zeitschrift veröffentlicht wurde Verfahren der Nationalen Akademie der Wissenschaften (PNAS) Letztes Jahr.
Das in PNAS veröffentlichte Papier zeigte, dass Intron-„Burst“-Ereignisse sehr früh in der Evolutionsgeschichte wahrscheinlich Tausende von Introns auf einen Schlag in ein Genom einführten. Ares und Corbett-Detig arbeiten derzeit daran, ein Burst-Ereignis künstlich nachzubilden, um Einblicke in die Reaktion der Genome zu erhalten, wenn es passiert.
Ares sagte, ihre interdisziplinäre Partnerschaft mit Corbett-Detig habe ihnen die Tür geöffnet, sich wirklich mit einigen der größten Geheimnisse der Introns auseinanderzusetzen, die sie ohne ihr kombiniertes Fachwissen wahrscheinlich nicht vollständig verstehen könnten.
„Es ist der beste Weg, Dinge zu erledigen“, sagte Ares. „Wenn Sie jemanden finden, der die gleichen Fragen im Kopf hat, aber andere Methoden, Perspektiven, Vorurteile und seltsame Ideen hat, wird es noch spannender. Es gibt Ihnen das Gefühl, dass Sie einem Problem wie diesem entkommen und es lösen können ist sehr komplex.
Mehr Informationen:
Manuel Ares et al., Intron-Lariat-Spliceosomen wandeln Lariate in echte Kreise um: Auswirkungen auf die Intron-Transposition, Gene und Entwicklung (2024). DOI: 10.1101/gad.351764.124
Bereitgestellt von der University of California – Santa Cruz
Zitat: Studie entdeckt zelluläre Aktivität, die darauf hindeutet, dass Recycling in unserer DNA vorhanden ist (11. Mai 2024), abgerufen am 11. Mai 2024 von https://phys.org/news/2024-05-CELLULAIRES-hints-recycling-dna html
Dieses Dokument unterliegt dem Urheberrecht. Mit Ausnahme der fairen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient lediglich der Information.