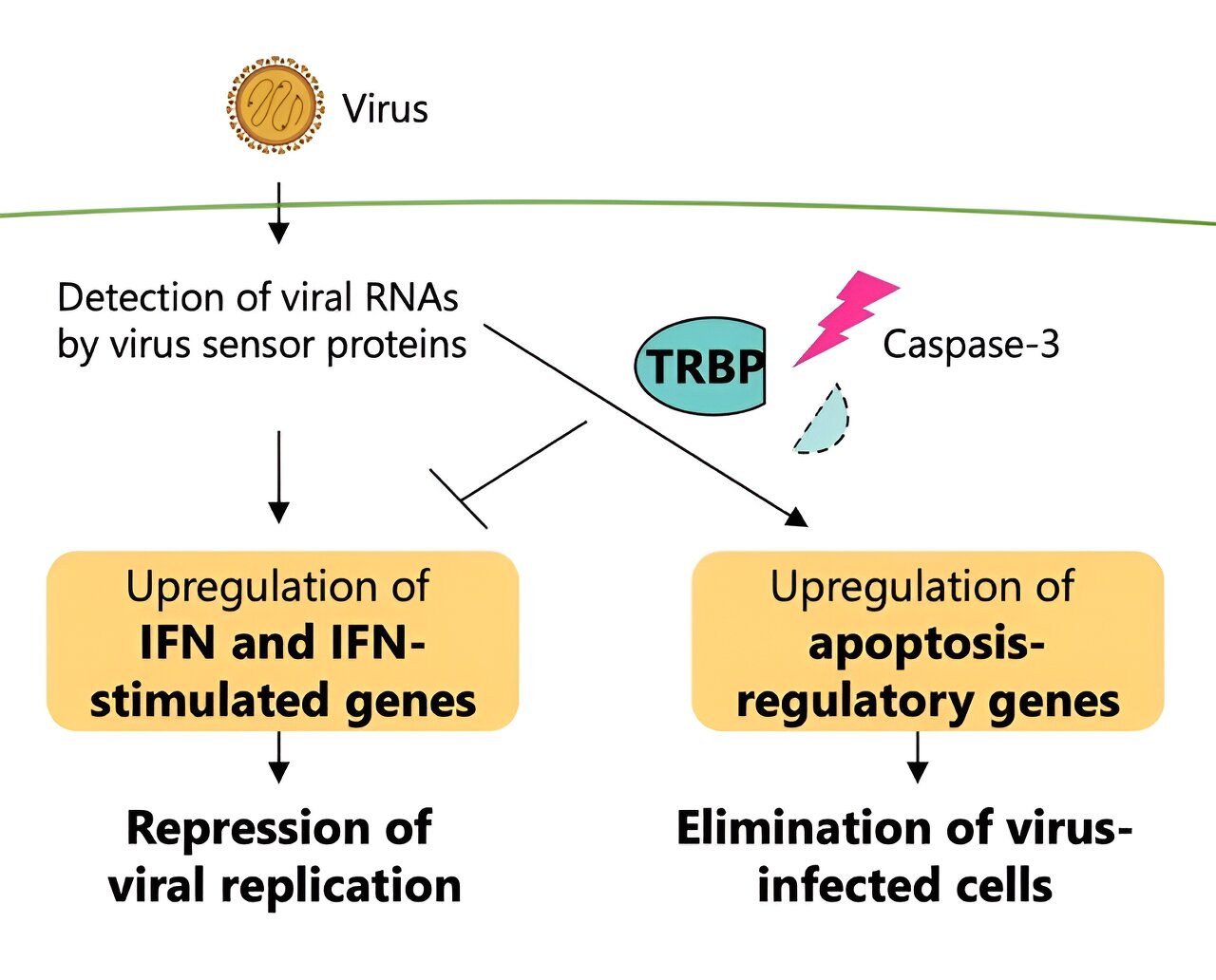
Forscher zeigten, dass die Behandlung des TRBP-Proteins die Apoptose steigert und dadurch die Interferon (IFN)-Signalübertragung während einer Virusinfektion verringert. Bildnachweis: Tomoko Takahashi (Saitama University/Universität Tokio) und Kumiko Ui-Tei (Universität Tokio)
Forscher haben den Regulierungsmechanismus eines bestimmten Proteins aufgeklärt, das eine Schlüsselrolle beim Ausgleich der durch Virusinfektionen in Säugetierzellen ausgelösten Immunantwort spielt. Diese Erkenntnisse könnten zur Entwicklung antiviraler Therapien und nukleinsäurebasierter Medikamente zur Behandlung genetischer Störungen beitragen. Die Forschung wird in der Zeitschrift veröffentlicht Nukleinsäureforschung.
Damit sich Zellen vor Virusinfektionen schützen können, kommt es typischerweise zu einer Reihe von Immunreaktionen, einschließlich des programmierten Zelltods namens Apoptose und der Interferon-Signalisierung. Wenn Apoptose ein normaler Prozess ist, der mit oder ohne Anwesenheit viraler Moleküle abläuft und einer Kaskade von Schritten folgt, die zum Absterben einer Zelle führen – was für den Wirt möglicherweise nicht vorteilhaft erscheint –, kann dies dazu beitragen, die Reproduktion abnormaler Zellen zu verhindern. , auch solche, die mit Viren infiziert sind, und eliminieren sie aus dem Körper.
Interferone hingegen sind Proteine, die von tierischen Zellen als Reaktion auf eine Virusinfektion produziert werden, um die Zelle vor einem Virusangriff zu schützen und die Vermehrung des Virus zu verhindern. Der Regulierungsmechanismus, durch den Zellen ein Gleichgewicht zwischen Apoptose und Interferon-Reaktion aufrechterhalten, um die Virusreplikation während einer Infektion wirksam zu unterdrücken, bleibt jedoch unklar.
In der aktuellen Studie konzentrierte sich ein Team, zu dem auch Forscher der Universität Tokio gehörten, auf ein bestimmtes Protein, TRBP, das auch als Proteintyp namens RNA-Silencing-Faktor klassifiziert wird.
RNA ist eine Nukleinsäure, eine organische Verbindung, die in lebenden Zellen und Viren vorkommt und die Proteinsynthese und die genetische Ausstattung vieler Viren steuert. RNA synthetisiert Proteine durch einen Prozess namens Translation, indem sie genetische Sequenzen liest und sie in Anweisungen übersetzt, die es Zellen ermöglichen, Proteine zu erzeugen, die in erster Linie für die Gesamtstruktur und Funktion des Organismus verantwortlich sind, egal ob es sich um eine Pflanze oder ein Tier handelt.
RNA-Silencing, auch RNA-Interferenz genannt, ist eine Möglichkeit für Pflanzen und Wirbellose, sich vor Viren zu schützen, indem sie virale RNA spalten, um die Virusreplikation zu unterdrücken.
„Diese Studie liefert eine wichtige Erkenntnis, die deutlich zeigt, dass das mit dem RNA-Silencing-Mechanismus in Verbindung stehende Protein, das bei Pflanzen oder Wirbellosen bekanntermaßen ein antiviraler Mechanismus ist, durch einen anderen Mechanismus auch bei Säugetieren stark mit der antiviralen Reaktion verknüpft ist“, sagte Co- Autorin Tomoko Takahashi, Gastwissenschaftlerin an der Universität Tokio und Assistenzprofessorin an der Saitama-Universität in Japan.
Obwohl allgemein anerkannt ist, dass es sich bei der RNA-Stummschaltung um einen Mechanismus handelt, der unter normalen Bedingungen die Genexpression steuert (wenn das Gen „eingeschaltet“ wird, um der Zelle Anweisungen zum Zusammenbau des von ihm kodierten Proteins zu geben), ist noch unklar, wie Dieser Prozess findet unter dem Stress einer Virusinfektion statt.
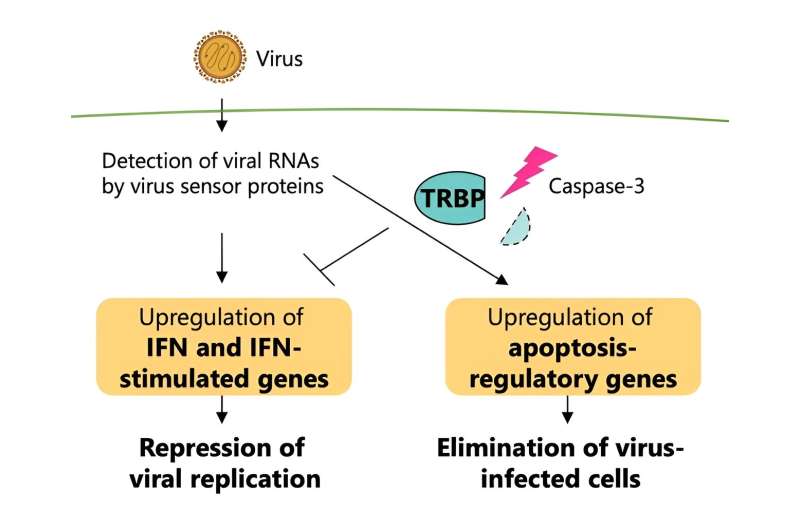
Forscher enthüllten den Regulierungsmechanismus eines bestimmten Proteins, TRBP, das eine Schlüsselrolle beim Ausgleich der durch Virusinfektionen in Säugetierzellen ausgelösten Immunantwort spielt. Bildnachweis: Tomoko Takahashi (Saitama University/Universität Tokio) und Kumiko Ui-Tei (Universität Tokio)
Die Forscher untersuchten daher TRBP (Abkürzung für TAR RNA-bindendes Protein), das eine wichtige Rolle bei der RNA-Inaktivierung während einer Virusinfektion zeigte.
Dieses Protein interagiert zu Beginn der Infektionsphase menschlicher Zellen mit einem Virusdetektorprotein. In späteren Stadien einer Virusinfektion werden Proteine namens Caspasen aktiviert, und diese Art von Protein ist hauptsächlich für die Auslösung des Zelltods verantwortlich.
„RNA-Stummschaltung und Interferon-Signalisierung galten früher als unabhängige Wege, aber mehrere Berichte, darunter auch unserer, haben eine Wechselwirkung zwischen ihnen gezeigt“, sagte Kumiko Ui-Tei, eine weitere Co-Autorin und außerordentliche Professorin an der Universität Tokio (zur Zeit der Veröffentlichung). Studie). die Studie).
Diese durch eine Virusinfektion ausgelöste funktionelle Umwandlung von TRBP liegt der Regulierung der Interferon-Reaktion und der Apoptose zugrunde, wobei TRBP den programmierten Zelltod infizierter Zellen irreversibel erhöht und gleichzeitig die Signalübertragung von Interferon reduziert. TRBP wirkt auf die Zelle, indem es den Zelltod auslöst und die Virusreplikation vollständig stoppt, im Gegensatz zum Interferon-Reaktionsweg, der lediglich die Virusreplikation unterdrückt, anstatt infizierte Zellen zu eliminieren.
„Das ultimative Ziel besteht darin, den molekularen Mechanismus zu verstehen, der dem antiviralen Abwehrsystem zugrunde liegt, das durch das Zusammenspiel zwischen internen und externen RNA-Pfaden in menschlichen Zellen gesteuert wird“, sagte Takahashi.
Durch ein tieferes Verständnis darüber, wie die Abwehr von Viren auf molekularer Ebene funktioniert, wollen Forscher die Entwicklung nukleinsäurebasierter Medikamente vorantreiben. Diese Medikamente verwenden zielgerichtete und hemmende Ansätze, die der antiviralen Reaktion des RNA-Knockdowns ähneln, und sie versprechen, bei der Behandlung eines breiteren Spektrums von Patienten mit Virusinfektionen, genetischen Mutationen und genetischen Anomalien zunehmend nützlich zu sein.
Diese Studie wurde in Zusammenarbeit mit der Saitama University, der Chiba University, der Kyoto University und dem Maebashi Institute of Technology in Japan durchgeführt.
Mehr Informationen:
Die Caspase-vermittelte TRBP-Prozessierung reguliert die Apoptose während einer Virusinfektion. Nukleinsäureforschung(2024). DOI: 10.1093/nar/gkae246
Zur Verfügung gestellt von der Universität Tokio
Zitat: Ein Schlüsselprotein reguliert die Immunantwort auf Viren in Säugetierzellen (18. April 2024), abgerufen am 18. April 2024 von https://phys.org/news/2024-04-key-protein-immune-response-viruses html
Dieses Dokument unterliegt dem Urheberrecht. Abgesehen von der fairen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient lediglich der Information.