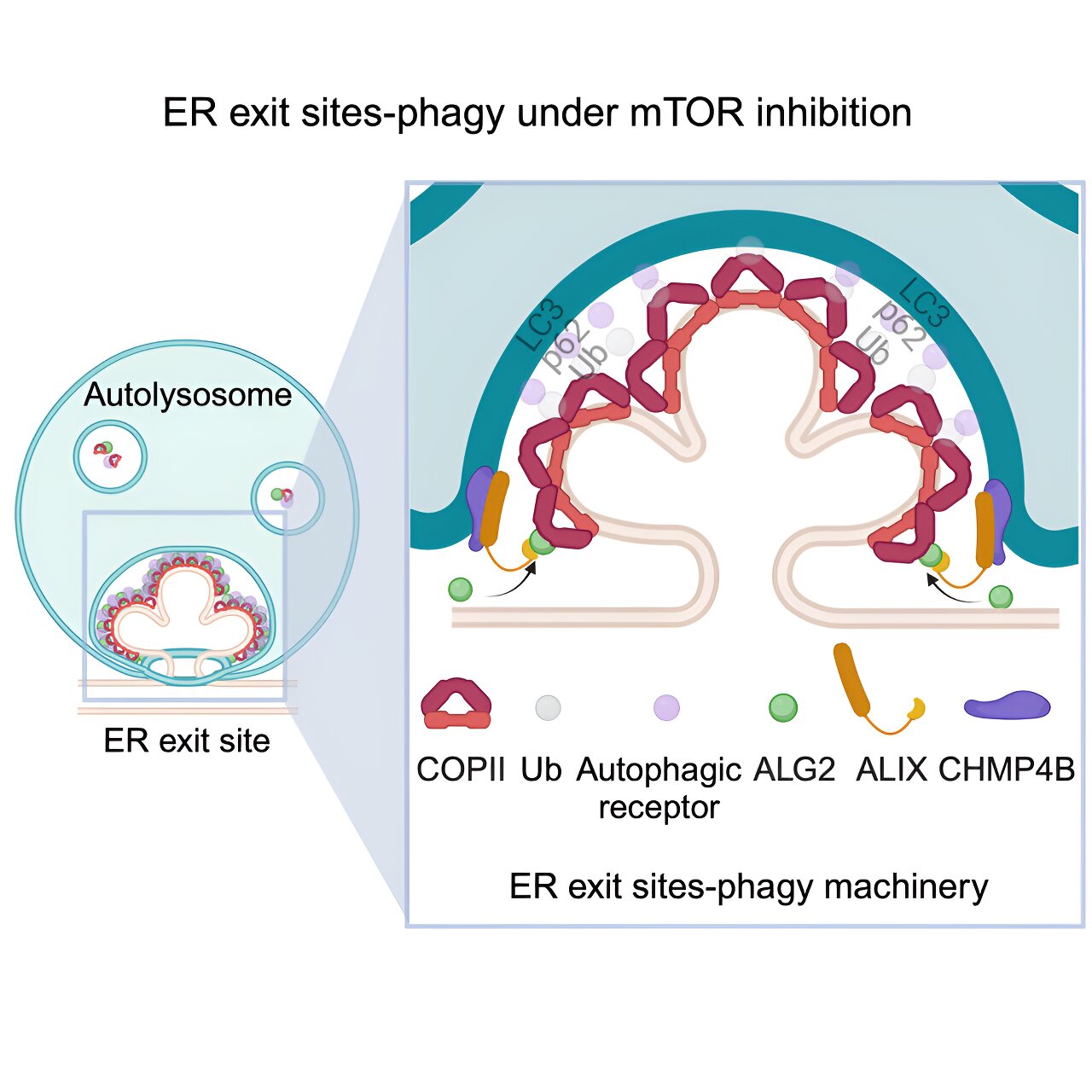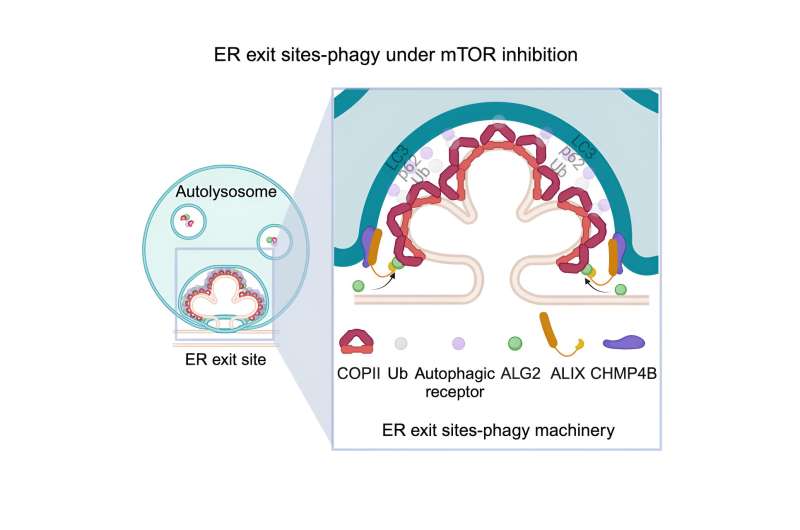
Grafische Zusammenfassung. Kredit: Entwicklungszelle (2024). DOI: 10.1016/j.devcel.2024.03.027
Eine neue Studie beschreibt detailliert, wie nährstoffarme Zellen Proteintransportstationen zum Abbau in zelluläre Recyclingzentren umleiten, und hebt einen neuen Ansatz hervor, den Zellen nutzen, um mit Stressbedingungen umzugehen.
Neue Proteine, die für die Außenseite der Zelle bestimmt sind, werden im endoplasmatischen Retikulum (ER), einer schlängelnden Membran innerhalb der Zelle, hergestellt. Röhrenförmige, traubenartige Wucherungen auf dem ER, sogenannte ER-Austrittsstellen, dienen als Transportstationen, an denen diese neu synthetisierten Proteine gesammelt und zur nächsten Etappe ihrer Reise transportiert werden.
In den letzten Jahren haben Wissenschaftler herausgefunden, dass diese ER-Austrittsstellen auch dazu beitragen, Zellmaterial und fehlgefaltete Proteine an Lysosomen (Organellen, die Material innerhalb der Zelle abbauen und recyceln) zu transportieren und eine Plattform für die Replikation von Viren, einschließlich COVID-19, bereitzustellen. Die Forscher fragten sich jedoch, wie diese Struktur, die Notausgangsstelle, an all diesen verschiedenen Funktionen teilnehmen könnte.
In einer neuen Studie veröffentlicht in EntwicklungszelleForscher am Janelia Research Campus des HHMI unter der Leitung von Ya-Cheng Liao, einem ehemaligen Postdoktoranden im Lippincott-Schwartz-Labor und jetzt Assistenzprofessor an der Columbia University, verwendeten hochauflösende Lebendzellbildgebung und Elektronenmikroskopie im Volumen, um die Wirkung von zu untersuchen Nährstoffe. Stress an Notausgangsstellen.
Das Team entdeckte, dass Stress eine Reihe von Molekülen auslöst, die zusammenarbeiten, um ER-Austrittsstellen zu Lysosomen zu leiten, wo sie zerstört werden – ein neuer Weg, den die Zelle nutzen kann, um die Aminosäuren freizusetzen, die zur Herstellung von Proteinen in der Zelle benötigt werden.
Zunächst zeigten die Forscher, wie ER-Austrittsstellen an bestimmte Arten von Lysosomen abgegeben und von diesen aufgenommen werden, wenn den Zellen Nährstoffe fehlen.
Als nächstes erläuterte das Team, wie dieser Prozess abläuft. Es beginnt, wenn hungernde Zellen die Freisetzung von Kalzium aus Lysosomen auslösen. Dies bewirkt die Rekrutierung eines Enzyms, ALG2, an den ER-Austrittsstellen, wo es an eine Struktur namens COPII bindet, die am Hals befestigt ist, der das ER mit der ER-Austrittsstelle verbindet.
Diese Verbindung zwischen ALG2 und COPII löst einen Prozess namens Ubiquitinierung aus, der am Proteinabbau beteiligt ist. Ein Lysosomenprotein, das an der Abgabe von Zellmaterial an die Organelle zur Zerstörung beteiligt ist, erkennt Ubiquitin, das durch den Prozess der Ubiquitinierung produziert wird, und treibt die ER-Austrittsstelle zum Lysosom.
Am Lysosom angekommen, bindet ALG2, das auf einer Seite an der ER-Austrittsstelle befestigt ist, mit seiner anderen Seite an ein anderes Protein, ALIX. ALIX interagiert mit ESCRT, einem Proteinkomplex, der auf der Oberfläche des an der Nahrungsaufnahme beteiligten Lysosoms vorhanden ist. Diese Interaktion führt dazu, dass die ER-Austrittsstelle und das Lysosom immer näher zusammenrücken, bis die ER-Austrittsstelle vom Lysosom verschlungen und aufgenommen wird.
Das Team beobachtete diesen Prozess nicht nur in lebenden Zellen, sondern rekonstruierte ihn auch in einem künstlichen System und bestätigte so, wie alle verschiedenen Komponenten zusammenarbeiten.
Die neue Arbeit beschreibt einen neuen Weg, den Zellen zur Stressbekämpfung nutzen, eine Idee, die Forschern helfen könnte, besser zu verstehen, wie Zellen und Organismen altern. Es könnte auch Aufschluss über andere Prozesse geben, an denen ER-Austrittsstellen beteiligt sind, einschließlich einer unkonventionellen Art und Weise, wie Viren über Lysosomen aus der Zelle transportiert werden, was Forschern bei der Entwicklung neuer Behandlungsmethoden helfen könnte.
Mehr Informationen:
Ya-Cheng Liao et al., COPII mit ALG2 und ESCRT kontrollieren die Lysosomen-abhängige Mikroautophagie von ER-Austrittsstellen, Entwicklungszelle (2024). DOI: 10.1016/j.devcel.2024.03.027
Bereitgestellt vom Howard Hughes Medical Institute
Zitat: Neue Studie beschreibt detailliert, wie hungernde Zellen Proteintransportstationen kapern (12. April 2024), abgerufen am 13. April 2024 von https://phys.org/news/2024-04-starving-cells-hijack-protein-stations.html
Dieses Dokument unterliegt dem Urheberrecht. Mit Ausnahme der fairen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient lediglich der Information.