Kredit: Entwicklungszelle (2024). DOI: 10.1016/j.devcel.2024.02.002
Autophagie, was wörtlich „sich selbst essen“ bedeutet, ist ein zellulärer Reinigungsprozess, der unseren Körper in gutem Zustand hält, aber zu viel Autophagie kann zu viel des Guten sein.
Forscher am Weizmann Institute of Science haben ein Lebensmittelkontrollgerät entdeckt, das verhindert, dass sich der Mund der autophagischen Maschinerie zu weit öffnet und so verhindert, dass sie alles frisst, was in Sichtweite ist. Die Studie ist veröffentlicht in Entwicklungszelle.
„Der von uns entdeckte Mechanismus ermöglicht es der Autophagie, so viel beschädigtes Material wie nötig zu verschlingen, aber nicht mehr“, erklärt Professor Zvulun Elazar vom Department of Biomolecular Sciences bei Weizmann, der das Forschungsteam leitete.
Die Spezialität der Autophagie ist die Entfernung großer Strukturen, wie beispielsweise beschädigter Proteinaggregate oder Organellenfraktionen. In extremen Situationen, wie z. B. beim Hungern, kann es zufällige Teile des Zellmaterials abbauen, um die Zelle mit den wesentlichen Bausteinen zu versorgen, die sie für die ordnungsgemäße Aufrechterhaltung ihrer laufenden Lebensprozesse benötigt.
Da Autophagie für viele Körpersysteme unerlässlich ist, insbesondere für die Aufrechterhaltung langlebiger Zellen, die sich nicht mehr teilen, wie z. B. Neuronen, können Defekte in dieser Zellerhaltung zu verschiedenen Krankheiten führen. Es ist bekannt, dass Defekte in der Autophagie beispielsweise zum Absterben von Neuronen bei der Parkinson-Krankheit und anderen neurodegenerativen Erkrankungen beitragen.
Es wird angenommen, dass der mit zunehmendem Alter eintretende Rückgang der Autophagie auch das Risiko für Krankheiten, einschließlich Krebs, erhöht. Ein besseres Verständnis der Mechanismen, die die Autophagie regulieren, könnte bei der Entwicklung neuer Therapien helfen, aber die bloße Verbesserung der Autophagie ist nicht immer die beste Lösung.
„Bei Krebs beispielsweise ist Autophagie ein zweischneidiges Schwert“, sagt Elazar. „Unzureichende Autophagie führt zur Ansammlung freier Radikale, die zur Entstehung von Krebs beitragen. Krebstumoren sind dann jedoch auf Autophagie angewiesen, um zu überleben.“
Die neue Studie in Elazars Labor unter der Leitung des Doktoranden Oren Shatz wollte herausfinden, wie der Körper die Autophagie reguliert. Da sich die Bedürfnisse der Zellen ständig ändern, wird die autophagische Maschinerie – ein Organell namens Autophagosom – jedes Mal von Grund auf neu aufgebaut und nach getaner Arbeit wieder abgebaut.
Die Membran der Autophagosomen-Vorläuferstruktur, Phagophor genannt, umhüllt das zu eliminierende Material und transportiert es zu einer „Deponie“, dem Lysosom, wo es abgebaut wird.
Einige Phagophoren schlucken alles, was sich ihnen in den Weg stellt, unselektiv. Für andere ist die Nahrungsaufnahme sehr selektiv. In diesem Fall werden sie von Proteinen unterstützt, die sie mit dem Löffel füttern und bestimmte Strukturen zu ihrem Mund führen.
Bisher herrschte die Meinung vor, dass sich in beiden Fällen das Maul des Fressers so weit wie möglich öffnet, um alles aufzunehmen, was gegessen werden muss. Die Ergebnisse der an Hefen durchgeführten Weizmann-Studie legen nahe, dass diese Ansicht bei weitem nicht den wahren Essgewohnheiten eines durchschnittlichen Autophagosoms entspricht.
„Wir haben einen Mechanismus entdeckt, der das Öffnen des Mundes des Phagophors steuert“, sagt Shatz. „Dies ist besonders wichtig im Fall der nicht selektiven Autophagie, die potenziell gefährlich ist, weil sie fälschlicherweise die gesamte Zelle von innen auffressen könnte.“
Der neu entdeckte Mechanismus stellt sicher, dass das Autophagosom bei der nicht-selektiven Autophagie seine klaffenden Kiefer nicht öffnen kann, um alles zu verschlingen, was ihm in den Weg kommt. Wenn sich die Membran zu bilden beginnt, wird vielmehr die Größe ihrer Öffnung begrenzt, wodurch begrenzt wird, was verschluckt werden kann, auch wenn die Membran selbst weiter wächst und sich ausdehnt, bis eine ausreichende Menge an zu entsorgendem Material eingefangen wird.
Folglich haben Phagophoren entgegen der klassischen Vorstellung nicht die Form einer Teetasse, also eines Mundes, der ihren gesamten Umfang einnimmt, sondern eine Amphore, eine sehr bekannte Form antiker griechischer Vasen, mit schmalem Durchmesser . , halsförmiger Rand.
Unabhängig von der Größe des „Gefässes“ bleibt die Öffnung dauerhaft verengt, bis das Autophagosom seine Pflicht erfüllt hat und wieder zerstört wird. Mit anderen Worten: Das Autophagosom ist kein gefräßiger Esser, sondern ein empfindlicher Esser, und die „Nahrung“ dringt durch Diffusion ein.
Die Forscher zeigten außerdem, dass der Phagophor selbst bei der selektiven Autophagie, bei der besondere Vorsicht durch Proteine geboten wird, die nach gefährlichen Materialien selektieren, seinen Mund nicht unkontrolliert öffnet. Die Größe der Apertur wird durch den gleichen Mechanismus reguliert, ist jedoch letztlich größer als beim nicht-selektiven Verfahren.
Letztendlich wird bei beiden Arten der Autophagie, ob selektiv oder nicht, dieser Mechanismus aufgehoben, sobald sich die Organelle satt gefressen hat, sodass sich die Öffnung schließen, die Membran verschließen und die verschluckte Substanz im Inneren verdaut werden kann.
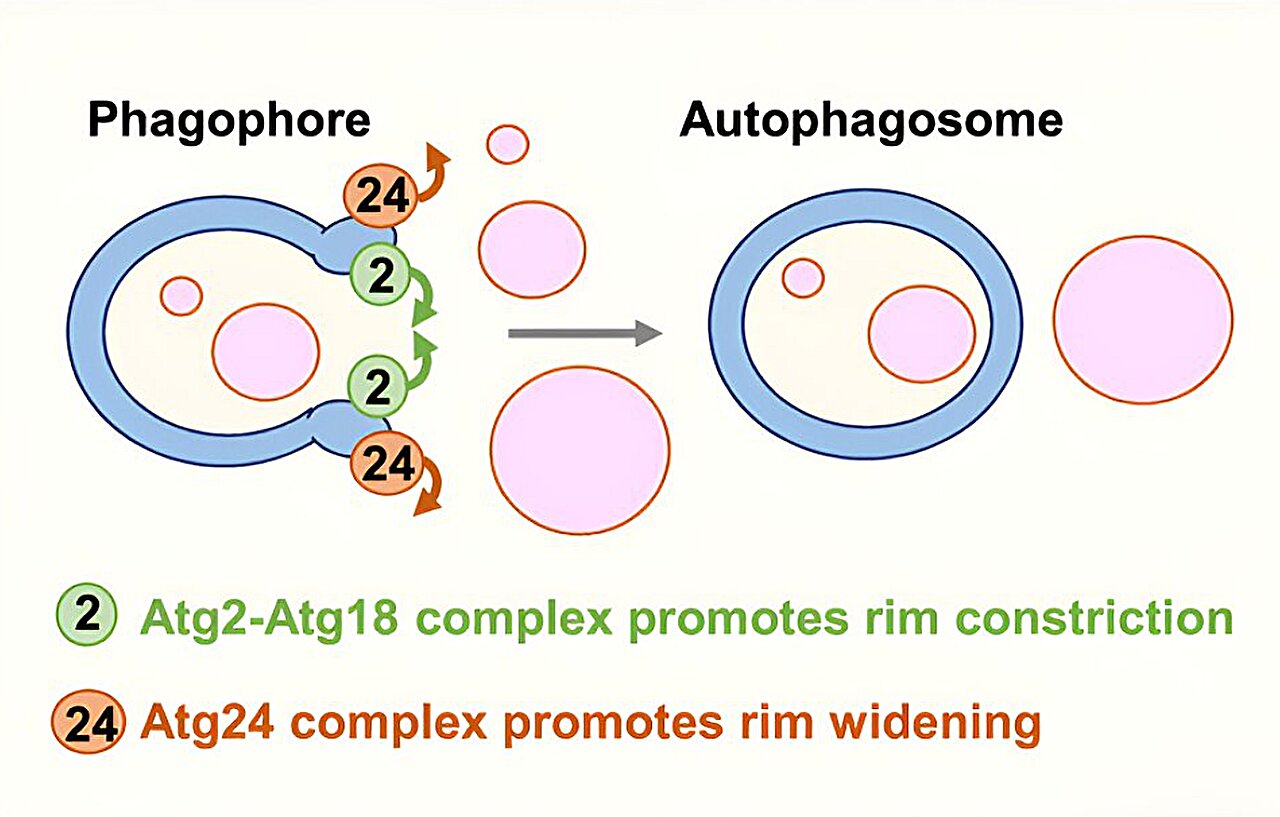
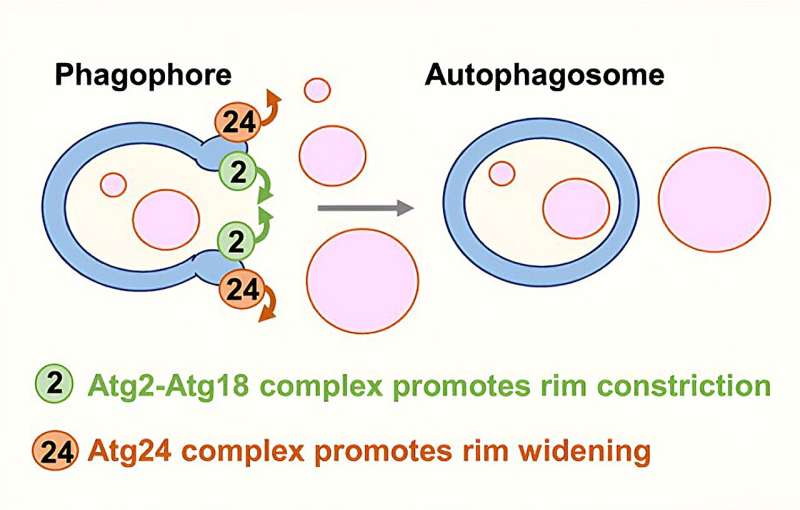
Shatz und seine Kollegen enthüllten dann die molekularen Details dieses Kontrollmechanismus. Dabei handelt es sich um zwei Hauptproteinkomplexe: einen namens Atg24-Atg20, der die Öffnung vergrößert, und einen anderen, Atg2-Atg18, der sie enger macht.
Es wurde festgestellt, dass die Aktivität der beiden Komplexe durch ihre Wechselwirkung mit PI3P, einer gut etablierten autophagischen Signalchemikalie, koordiniert wird: Die beiden Komplexe konkurrieren um die Bindung an PI3P-Moleküle, die als Haftpuffer dienen.
Nachdem die Wissenschaftler diese Hauptakteure identifiziert hatten, zeigten sie, dass sie sie manipulieren konnten, um die Öffnung des Phagophors je nach Bedarf zu vergrößern oder zu verkleinern.
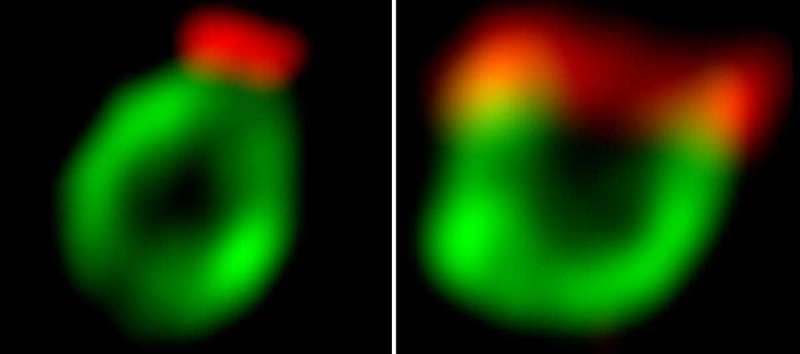
Links: Der Mund (rot) eines Phagophors (grün) wird durch die koordinierte Wirkung zweier Proteinkomplexe, Atg2-Atg18 und Atg24-Atg20, schmal gehalten. Rechts: Als Wissenschaftler die Aktivität des Atg2-Atg18-Komplexes reduzierten, öffnete sich der Mund weit. Bildnachweis: Weizmann Institute of Science
Diese Erkenntnisse wurden dank einer Reihe anspruchsvoller Fortschritte ermöglicht, die während der Studie erzielt wurden. Insbesondere entwickelte Shatz Möglichkeiten, die Aktivität des Atg24-Atg20-Komplexes zu erhöhen und die Aktivität des Atg2-Atg18-Komplexes zu verringern, anstatt ihre Gene zu überexprimieren oder vollständig auszuschalten, wie es in der molekularen Zellbiologie häufig der Fall ist.
Darüber hinaus entwickelten er und seine Kollegen eine innovative Methode, um mehrere Proteine in einem einzigen Experiment mit unterschiedlichen Farben zu markieren.
Die Studienergebnisse tragen zu einem tiefgreifenden Verständnis der Autophagie bei, das in Zukunft den Weg für medizinische Anwendungen ebnen könnte. „Wenn man ein Auto reparieren will, muss man seine Teile kennen und genau wissen, was sie tun“, sagt Elazar. „Ebenso müssen wir detaillierte Kenntnisse über die Mechanismen der Autophagie erlangen, um sie eines Tages auf die richtigen Werte in unserem Körper einstellen zu können.“
Mehr Informationen:
Oren Shatz et al.: Die Randöffnung von autophagischen Hefemembranen gleicht den Frachteinschluss mit der Vesikelreifung aus. Entwicklungszelle (2024). DOI: 10.1016/j.devcel.2024.02.002
Bereitgestellt vom Weizmann Institute of Science
Zitat: Autophagische Organellen begrenzen die Mundgröße, um die Zellreinigung zu regulieren, wie eine Studie zeigt (3. Juni 2024), abgerufen am 3. Juni 2024 von https://phys.org/news/2024-06-autophagic-organelles-restrict-mouth-size. HTML
Dieses Dokument unterliegt dem Urheberrecht. Mit Ausnahme der fairen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient lediglich der Information.