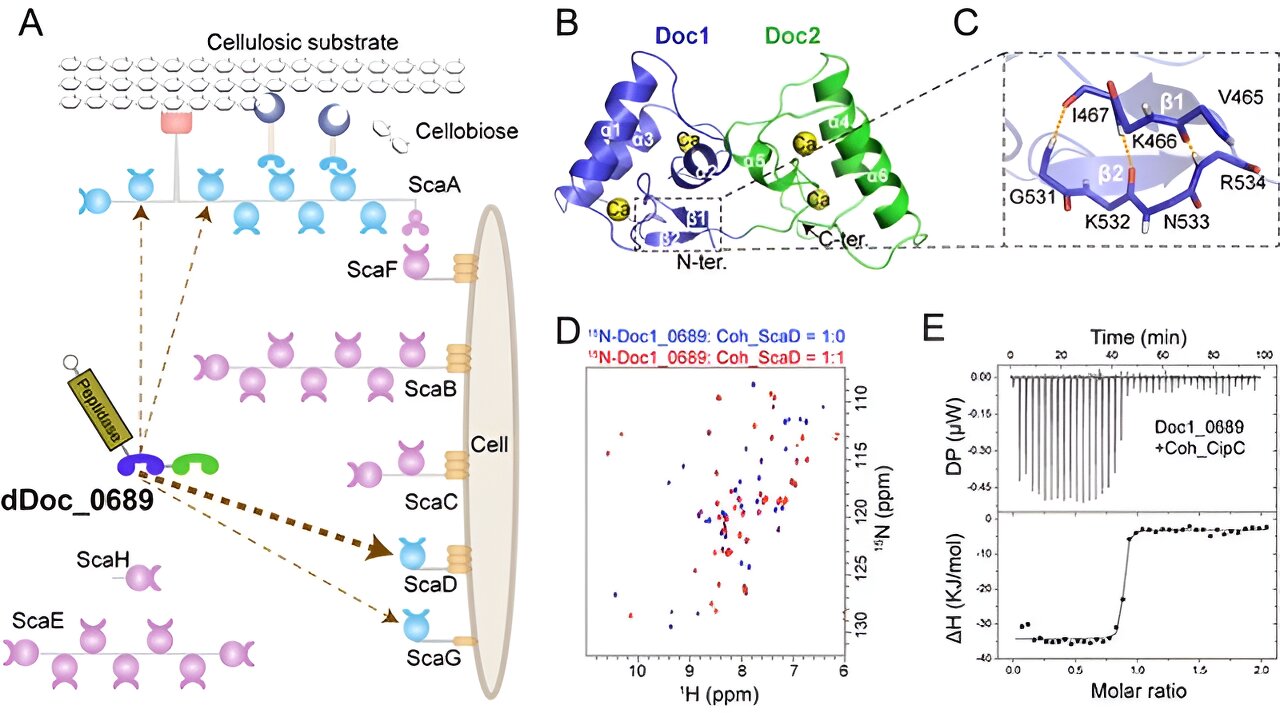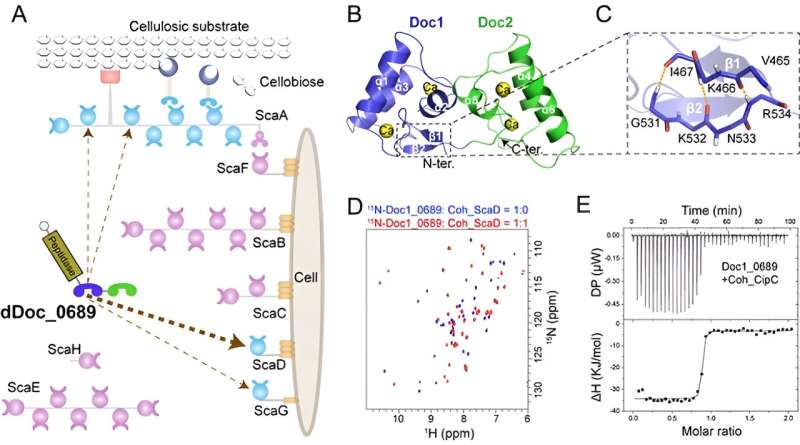
Struktur und Aufbaumechanismus des einzigartigen Doppel-Dockerin-Moduls in Clostridium thermocellum. Bildnachweis: Chen Chao und Feng Yingang
Cellulosomen sind Multienzymkomplexe, die für ihren effizienten Abbau von Lignocellulose bekannt sind, der für die Entwicklung bioenergetischer Techniken wertvoll ist. Die vielfältige Zusammensetzung und der komplexe Aufbau von Cellulosomen verleihen ihnen außergewöhnliche Fähigkeiten beim Substratabbau. Die Entschlüsselung ihrer komplexen Aufbaumechanismen kann Einblicke in ihre Effizienz liefern und ihre Anwendungen in der Bioenergieproduktion fördern.
Forscher des Qingdao-Instituts für Bioenergie und Bioprozesstechnologie der Chinesischen Akademie der Wissenschaften charakterisierten die Struktur und den Aufbaumodus eines einzigartigen Cellulose-Aufbaumoduls, des Double-Dockerin-Moduls, und enthüllten die komplexe Komplexität und Vielfalt der zellulosomalen Anordnung und Regulierung. Die Ergebnisse wurden veröffentlicht in Proteinwissenschaft.
Cellulosomen werden durch das Zusammenspiel von Gerüstproteinen (Gerüsten) und Enzymen zusammengesetzt. Nichtkatalytische Gerüste enthalten mehrere Cohesin-Module im Tandem, während Celluloseenzyme mit einem einzigen Dockerin-Modul ausgestattet sind, das eine spezifische Bindung an die Gerüste ermöglicht. Daher wird die strukturelle Komplexität des Cellulosoms hauptsächlich durch die Anzahl und Art(en) der Kohäsine in den Gerüsten bestimmt.
Jüngste Omics-Daten zeigen jedoch das Vorhandensein von Doppel- und Mehrfach-Tandem-Dockerin-Modulen in einigen Cellulosom-produzierenden Bakterien. Die Rolle dieser Module in Cellulosomen muss geklärt werden.
In dieser Studie entdeckten Forscher ein einzigartiges Doppel-Dockerin-Modul innerhalb einer Proteasekomponente des Clostridium thermocellum-Cellulosoms.
Strukturanalysen von Kristallen und NMR ergaben, dass das Doppel-Dockerin-Modul zwei typische Dockerin-Strukturen aufweist. Allerdings wurde im ersten Dockerin-Modul ein neuartiger intramolekularer Verschluss aus antiparallelen β-Strängen identifiziert, und die mutmaßlichen kohäsinbindenden Reste in jedem Modul weisen im Vergleich zu anderen herkömmlichen Dockerin-Modulen einige Abweichungen auf.
Weitere Interaktionsstudien zeigten, dass nur das erste Dockerin-Modul am Aufbauprozess beteiligt ist, was zeigt, dass die Kohäsinbindung eines bestimmten Zellwandbindungsgerüsts bevorzugt wird. Dies deutet darauf hin, dass das duale Dockerin-Modul möglicherweise eine Rolle bei der Regulierung der Zellulosomassemblierung spielt.
Darüber hinaus entdeckten die Forscher, dass das Doppel-Dockerin-Modul eine bemerkenswerte Fähigkeit besitzt, an das heterologe Cohesin-Modul von Clostridium cellulolyticum zu binden. Diese Entdeckung stellt ein neues Beispiel für die mögliche Bildung „symbiotischer Cellulosomen“ innerhalb einer mikrobiellen Gemeinschaft dar.
„Diese Studie zeigt, dass Cellulosomen viel komplexer sind, als wir dachten, und dass das Verständnis dieser Komplexität für ihre Anwendung von entscheidender Bedeutung ist“, sagte Professor Feng Yingang, korrespondierender Autor der Studie.
Mehr Informationen:
Chao Chen et al., Ein doppeltes Dockerin-Zellulosomalmodul aus Clostridium thermocellum weist ausgeprägte Struktur- und Kohäsin-Bindungsmerkmale auf. Proteinwissenschaft (2024). DOI: 10.1002/pro.4937
Zur Verfügung gestellt von der Chinesischen Akademie der Wissenschaften
Zitat: Forscher enthüllen die Struktur und den Aufbaumechanismus eines einzigartigen Moduls im Cellulosom (29. März 2024), abgerufen am 30. März 2024 von https://phys.org/news/2024-03-reveal-mechanism-unique -module-cellulosome .html
Dieses Dokument unterliegt dem Urheberrecht. Mit Ausnahme der fairen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient lediglich der Information.