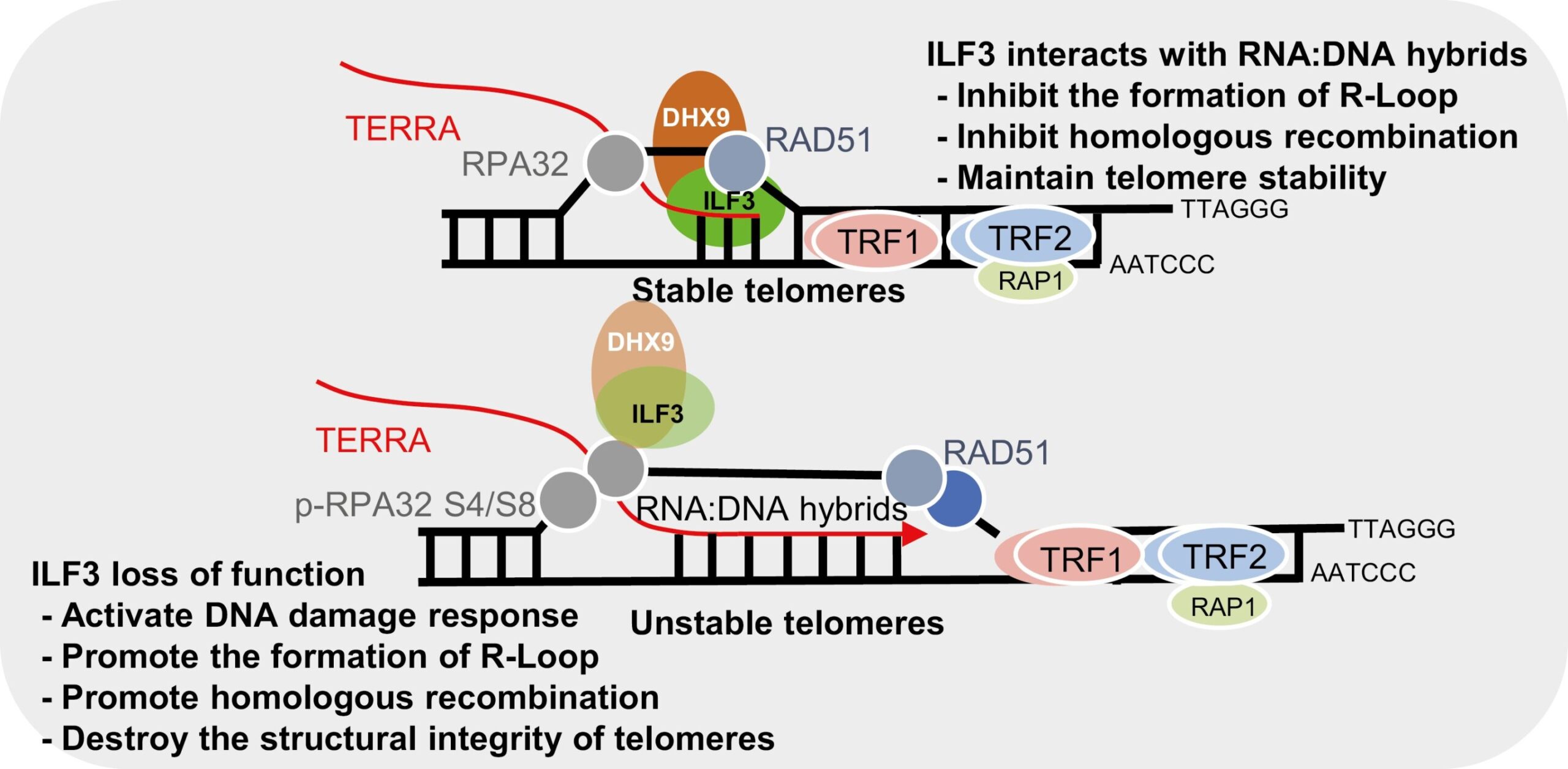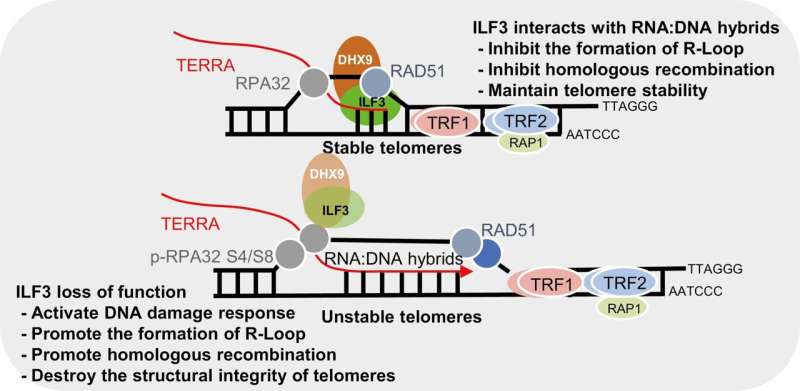
Grafische Zusammenfassung. Kredit: Proteine und Zellen (2023). DOI: 10.1093/procel/pwad054
Fehlregulierte R-Schleifen können zum Stillstand der Replikationsgabel und zur Telomerinstabilität führen. Allerdings ist die Art und Weise, wie R-Schleifen erkannt und reguliert werden, insbesondere bei Telomeren, noch nicht vollständig verstanden.
In einer neuen Studie identifizierten Forscher mithilfe der Proximity-Dependent-Biotin-Identification-Technologie (BioID) das ILF3-Interaktom und fanden heraus, dass ILF3 mit mehreren DNA/RNA-Helikasen, einschließlich DHX9, interagiert. Diese Wechselwirkung legt nahe, dass ILF3 die Auflösung telomerer R-Schleifen erleichtern und dadurch eine abnormale homologe Rekombination verhindern und die Telomerhomöostase aufrechterhalten kann.
Die Arbeit mit dem Titel „ILF3 schützt Telomere vor aberranter homologer Rekombination als telomerer R-Loop-Antrieb“ wurde in veröffentlicht Proteine und Zellen.
Zu den wichtigsten Ergebnissen der Studie gehören:
- ILF3 zeigt eine selektive Wechselwirkung mit telomeren R-Schleifen und schützt so Telomere vor fehlerhafter homologer Rekombination.
- Der Verlust der ILF3-Funktion führt folglich zu einem Anstieg der TERRA-Spiegel und löst die Ansammlung von R-Loops an Telomeren aus. Diese Akkumulation führt zu einer DNA-Schadensreaktion (DDR) und einer Telomerdysfunktion, die durch erhöhte TIFs, Telomerfragilität und das Vorhandensein extrachromosomaler Telomerfragmente gekennzeichnet ist, die wiederum den ALT-Signalweg aktivieren können.
- Darüber hinaus ergab die Kartierung des ILF3-Interaktoms Wechselwirkungen mit verschiedenen DNA/RNA-Helikasen, einschließlich DHX9, mit der signifikanten Schlussfolgerung, dass ILF3 durch seine Wechselwirkung mit DHX9 möglicherweise zur Auflösung telomerer R-Loops beiträgt.
- ILF3 fungiert möglicherweise als Leser telomerer R-Schleifen und trägt so zur Verhinderung fehlerhafter homologer Rekombination und zur Aufrechterhaltung der Telomerhomöostase bei.
Diese Ergebnisse bestätigen, dass ILF3 mit telomeren RNA:DNA-Hybridstrukturen wie R-Loops interagiert und die Auflösung fördert oder eine übermäßige Akkumulation von R-Loops über die RNA-Helikase DHX9 hemmt.
Diese Forschung liefert neue Einblicke in die Regulierung telomerer R-Schleifen und die Mechanismen, die die Telomerhomöostase aufrechterhalten, mit Auswirkungen auf die Biologie des Alterns.
Mehr Informationen:
Chuanle Wang et al., ILF3 schützt Telomere vor fehlerhafter homologer Rekombination als telomerer R-Loop-Leser, Proteine und Zellen (2023). DOI: 10.1093/procel/pwad054
Bereitgestellt von Frontiers Journals
Zitat: Die Ergebnisse deuten darauf hin, dass ILF3 als telomerer R-Loop-Reader fungieren könnte, um die Telomerhomöostase aufrechtzuerhalten (22. April 2024), abgerufen am 22. April 2024 von https://phys.org/news/2024-04-ilf3-function-reader -telomeric-loops.html
Dieses Dokument unterliegt dem Urheberrecht. Mit Ausnahme der fairen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient lediglich der Information.