Kredit: Optoelektronische Fortschritte (2024). DOI: 10.29026/oea.2024.240013
Die Phototherapie ist eine sichere und wirksame Methode zur Behandlung von Tumoren, einschließlich der photothermischen Therapie (PTT) und der photodynamischen Therapie (PDT). PTT bezieht sich auf die Verwendung von Lasern zur Aktivierung photothermischer Umwandlungsmittel und zum Einsatz hoher Temperaturen zur Abtötung von Tumorzellen, während PDT Photosensibilisatoren dazu anregt, reaktive Sauerstoffspezies (ROS) zu produzieren, um Tumorzellen abzutöten.
Studien haben das kombinierte therapeutische Potenzial von PTT/PDT gezeigt, aber aufgrund des niedrigen Sauerstoffgehalts von Tumoren ist eine Monotherapie oft nicht ausreichend, um wirksame und langfristige therapeutische Wirkungen auf Tumore zu erzielen.
Gleichzeitig ist die Fähigkeit der Phototherapie, die Krebsimmunantwort auszulösen, begrenzt, und eine lokale Immunstimulation ist schwierig, die systemische Antitumor-Immunantwort zu aktivieren. Die Verbesserung der Fähigkeit der Phototherapie zur Stimulierung der systemischen Immunantwort erfordert weitere Forschung.
Stickstoffmonoxid (NO) hat mehrere Funktionen in den physiologischen und pathologischen Prozessen des menschlichen Körpers und es kommt zu einer entscheidenden Wechselwirkung zwischen ihm und reaktiven Sauerstoffspezies (ROS), die durch PDT erzeugt werden, um reaktive Sauerstoffspezies (ROS-Stickstoff (RNS)) zu bilden.
Diese RNS könnten die Wirksamkeit der PDT unter hypoxischen Bedingungen verbessern, indem sie Tumorzellen abtöten und gleichzeitig die Immunantwort erheblich beeinflussen.
Die aktuelle Studie zeigt, dass RNS immunsuppressive Zellen unterdrücken und tumorassoziierte Makrophagen in M1-ähnliche Phänotypen polarisieren kann. Daher hat die Strategie der NO/ROS/RNS-Kaskadenerzeugung ein großes Potenzial, langfristige systemische Antitumor-Immunantworten zu aktivieren.
Allerdings wird die RNS-Erzeugung durch die Schwierigkeit, Ort und Zeitpunkt der NO-Freisetzung genau zu steuern, sowie durch die kurze Lebensdauer (typischerweise 3–6 ms) und den begrenzten Diffusionsbereich (~ 20 nm) von Singulett-Sauerstoff erschwert.
Durch die Verwendung von Nanopartikeln zur gleichzeitigen Abgabe von NO-Donor und Photosensibilisator und die Anwendung von Laserbestrahlung auf die Tumorstelle, um gleichzeitig PTT/PDT zu initiieren, kann eine Vor-Ort-Kaskade der NO/ROS/RNS-Freisetzung erreicht werden die RNS-Produktion und die Antitumorwirksamkeit erheblich verbessern.
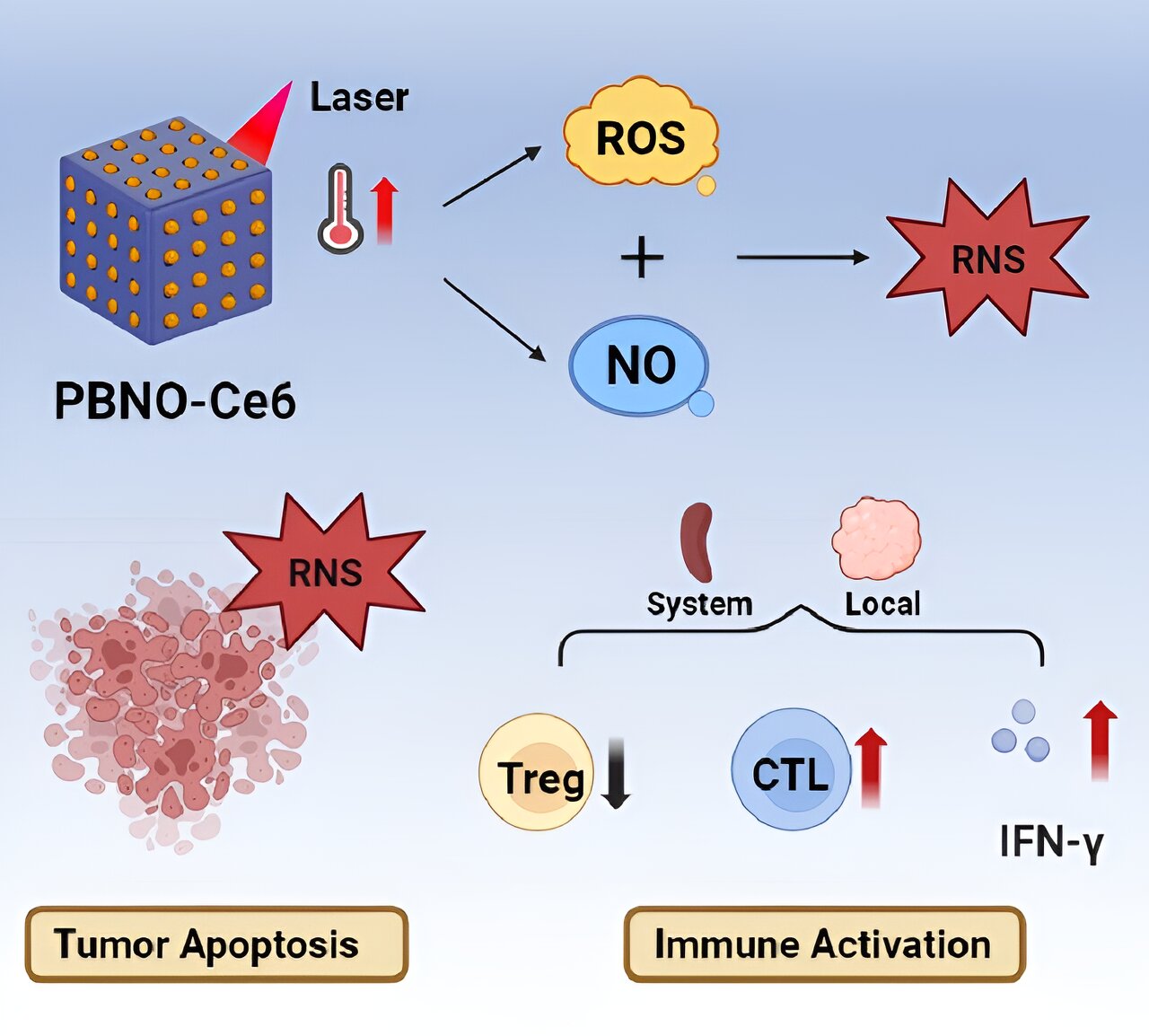
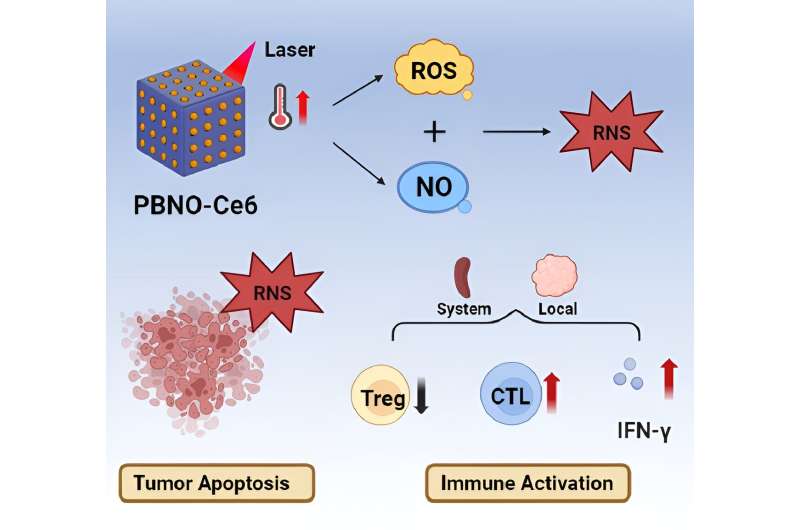
Autoren einer neuen Studie schlagen einen NIR-Trigger-aktivierten reaktiven Stickstoff-Nanoreaktor (PBNO-Ce6) vor, der gleichzeitig Stickoxid (NO), reaktive Sauerstoffspezies (ROS) und reaktive Stickstoffspezies (RNS) vor Ort produzieren kann, um den Tumor abzutöten . Zellen in vivo verbessern die langfristige lokale und systemische Antitumor-Immunantwort und schützen das Gewebe vor einem erneuten Tumorangriff. Der Artikel wird in der Zeitschrift veröffentlicht Optoelektronische Fortschritte.
Dieser Nanoreaktor basiert auf Berliner Blau (PB)-Nanopartikeln. PBNO-Nanopartikel, die nach Laserstimulation NO freisetzen können, wurden zunächst durch Dotieren der Kristallstruktur von PB mit Natriumnitroprussid (SNP) als NO-Donor synthetisiert. Anschließend wurde der Photosensibilisator Ce6 auf die Oberflächenmesoporen der Nanopartikel geladen, um eine PTT zu erhalten /PDT. kombinierte Therapie.
Das freigesetzte NO verbindet sich mit ROS, die von RNS-Photosensibilisatoren produziert werden, was die photodynamische/photothermische therapeutische Wirkung auf Tumore deutlich verstärkt und die Antitumor-Immunantwort aktiviert.
Es wurde bestätigt, dass PBNO-Ce6 durch Laserbestrahlung erwärmt wurde und die Tumortötungskapazität von NO in Kombination mit ROS in vitro und in vivo im Vergleich zur Monotherapie signifikant erhöht war. Wie die Ergebnisse der Färbung lebender und toter Zellen sowie der Durchflusszytometrie zeigen, induzierte PBNO-Ce6 mehr Apoptose in Tumorzellen.
Von größtem Interesse war seine Fähigkeit, die Aktivierung der Immunantwort zu modulieren, wobei die Behandlung mit PBNO-Ce6 zu einem signifikanten 2,7-fachen Anstieg der zytotoxischen T-Zellen und einer 62-prozentigen Reduzierung der regulatorischen T-Zellen im Vergleich zur Kontroll-PB-Ce6 (Preußisch Blau) führte. mit Ce6 beladene Nanopartikel) berichteten über eine deutliche Verbesserung im Vergleich zur herkömmlichen PTT/PDT.
PBNO-Ce6 fungiert als beispielloser NIR-ausgelöster RNS-Nanoreaktor mit synergistischen photodynamischen/photothermischen Effekten und starker immunstimulierender Aktivität. Diese Designstrategie kann als vielseitige Plattform in Kombination mit Immun-Checkpoint-Inhibitoren oder Chemotherapie eingesetzt werden, um die Prognose von Malignomen weiter zu verbessern.
Mehr Informationen:
Ziqing Optoelektronische Fortschritte (2024). DOI: 10.29026/oea.2024.240013
Unterstützt von Compuscript Ltd
Zitat: Verbesserung der Fähigkeit der Phototherapie, die systemische Immunantwort auf Krebs zu stimulieren (14. Juni 2024), abgerufen am 14. Juni 2024 von https://phys.org/news/2024-06-ability-phototherapy-immune-response-cancer. html
Dieses Dokument unterliegt dem Urheberrecht. Abgesehen von der angemessenen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient lediglich der Information.