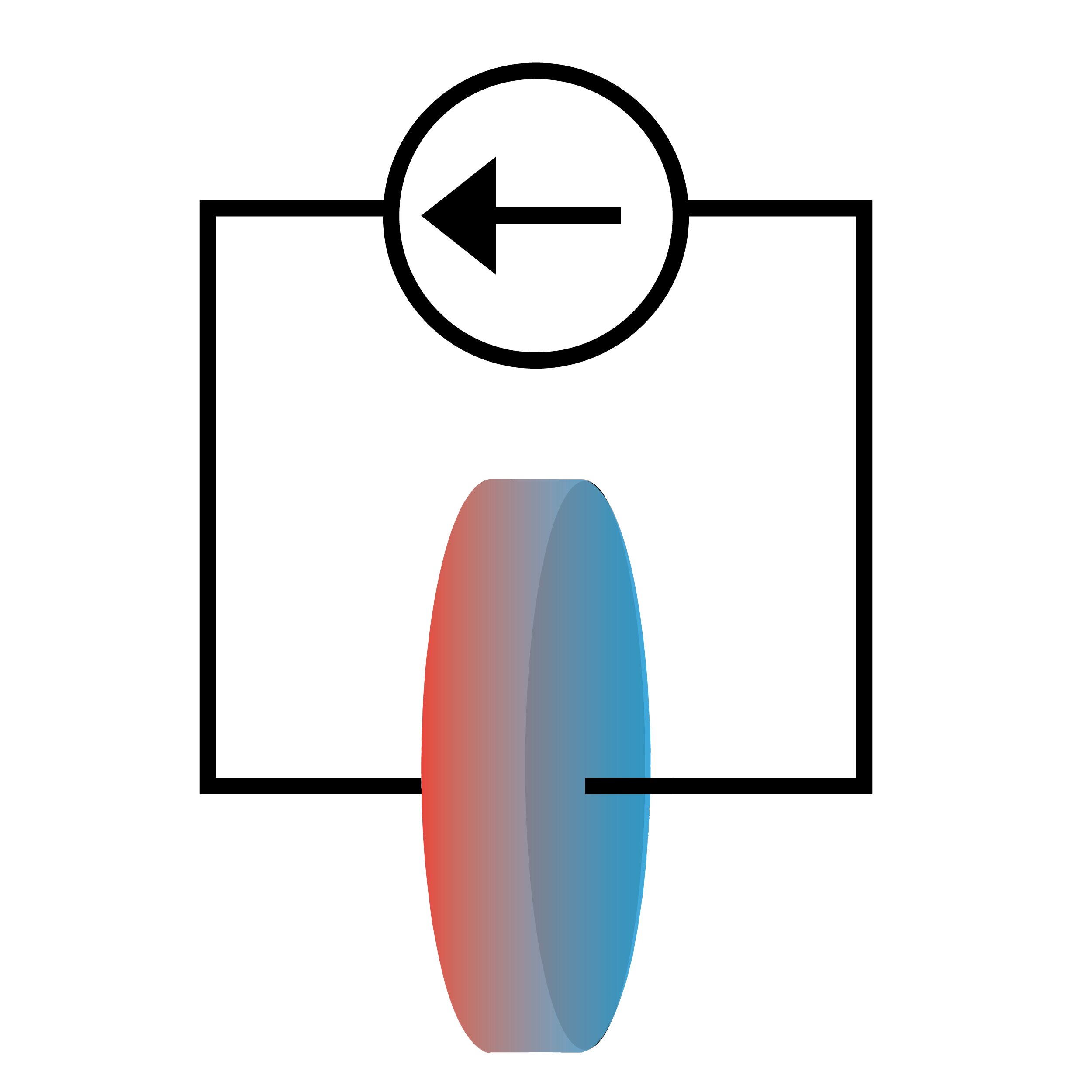
Forscher untersuchten, wie elektrischer Strom Wärmeströme in einer Lithium-Ionen-Batteriezelle erzeugt. Die Wärme floss entgegen dem elektrischen Strom, was zu einer höheren Temperatur auf der Seite führte, wo der Strom in die Zelle eintritt. Bildnachweis: Das Grainger College of Engineering an der University of Illinois in Urbana-Champaign
Normalerweise werden Batterien anhand ihrer elektrischen Eigenschaften wie Spannung und Strom untersucht. Neue Forschungsergebnisse deuten jedoch darauf hin, dass die Beobachtung des Wärmeflusses in Verbindung mit Elektrizität wichtige Erkenntnisse über die Batteriechemie liefern kann.
Ein Forscherteam der University of Illinois in Urbana-Champaign hat gezeigt, wie man die chemischen Eigenschaften von Lithium-Ionen-Batteriezellen mithilfe des Peltier-Effekts untersuchen kann, bei dem elektrischer Strom dazu führt, dass ein System Wärme zieht. In der Zeitung berichtet Chemie, Physik, Physik, ChemieDiese Technik ermöglichte es ihnen, die Entropie des Lithium-Ionen-Elektrolyten experimentell zu messen, eine thermodynamische Eigenschaft, die direkten Einfluss auf das Design von Lithium-Ionen-Batterien haben könnte.
„Unsere Arbeit besteht darin, die grundlegende Thermodynamik gelöster Lithiumionen zu verstehen, Informationen, von denen wir hoffen, dass sie die Entwicklung besserer Elektrolyte für Batterien leiten werden“, sagte David Cahill, Professor für Materialwissenschaften und Ingenieurwesen an der University of I. und Projektleiter. „Durch die Messung des gekoppelten Transports von elektrischer Ladung und Wärme im Peltier-Effekt können wir Rückschlüsse auf die Entropie ziehen, eine Größe, die eng mit der chemischen Struktur gelöster Ionen und deren Wechselwirkung mit anderen Teilen der Batterie zusammenhängt.“
Der Peltier-Effekt ist in Halbleitersystemen gut untersucht, wo er zum Kühlen und Kühlen eingesetzt wird. In ionischen Systemen wie dem Lithiumelektrolyten ist es jedoch noch weitgehend unerforscht. Der Grund dafür ist, dass die Temperaturunterschiede, die durch Peltier-Heizung und -Kühlung entstehen, im Vergleich zu anderen Effekten gering sind.
Um dieses Hindernis zu überwinden, verwendeten die Forscher ein Messsystem, das ein Hunderttausendstel Grad Celsius auflösen kann. Dadurch konnten die Forscher die Wärme zwischen den beiden Enden der Zelle messen und daraus die Entropie des Lithium-Ionen-Elektrolyten in der Zelle berechnen.
„Wir messen eine makroskopische Eigenschaft, aber sie liefert dennoch wichtige Informationen über das mikroskopische Verhalten der Ionen“, sagte Rosy Huang, Doktorandin in Cahills Forschungsgruppe und Co-Hauptautorin der Studie. „Messungen des Peltier-Effekts und der Lösungsentropie hängen eng mit der Solvatationsstruktur zusammen. Bisher verließen sich Batterieforscher auf Energiemessungen, aber die Entropie würde eine wichtige Ergänzung zu diesen Informationen darstellen und ein vollständigeres Bild des Systems liefern.“
Die Forscher untersuchten, wie der Peltier-Wärmefluss in Abhängigkeit von der Lithiumionenkonzentration, dem Lösungsmitteltyp, dem Elektrodenmaterial und der Temperatur variierte. In allen Fällen beobachteten sie, dass der Wärmefluss dem Ionenstrom in der Lösung entgegengesetzt war, was darauf hindeutet, dass die Entropie, die aus der Auflösung von Lithiumionen resultiert, geringer ist als die Entropie von festem Lithium.
Die Möglichkeit, die Entropie von Lithium-Ionen-Elektrolytlösungen zu messen, kann wichtige Informationen über die Ionenmobilität liefern, die den Ladezyklus der Batterie bestimmt, und darüber, wie die Lösung mit Elektroden interagiert, ein wichtiger Faktor für die Batterielebensdauer.
„Ein unterschätzter Aspekt des Batteriedesigns ist, dass der flüssige Elektrolyt bei Kontakt mit den Elektroden chemisch nicht stabil ist“, sagte Cahill. „Es zerfällt immer noch und bildet eine sogenannte Festelektrolyt-Interphase. Um eine Batterie über lange Zyklen stabil zu machen, muss man die Thermodynamik dieser Interphase verstehen, was unsere Methode tut.“
Zhe Cheng ist der zweite Co-Senior-Autor der Studie. Beniamin Zahiri, Patrick Kwon und Paul Braun, Professor für Materialwissenschaften und Ingenieurwesen an der U of I, haben ebenfalls zu dieser Arbeit beigetragen.
Mehr Informationen:
Zhe Cheng et al., Ionischer Peltier-Effekt in Li-Ionen-Elektrolyten, Chemie, Physik, Physik, Chemie (2024). DOI: 10.1039/D3CP05998G
Bereitgestellt vom Grainger College of Engineering der University of Illinois
Zitat: Was uns Wärme über die Batteriechemie sagen kann: Verwendung des Peltier-Effekts zur Untersuchung von Lithium-Ionen-Zellen (9. März 2024), abgerufen am 9. März 2024 von https://phys.org/news/2024-03-battery-chemistry- Peltier-Lithium-Effekt.html
Dieses Dokument unterliegt dem Urheberrecht. Abgesehen von der fairen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient lediglich der Information.