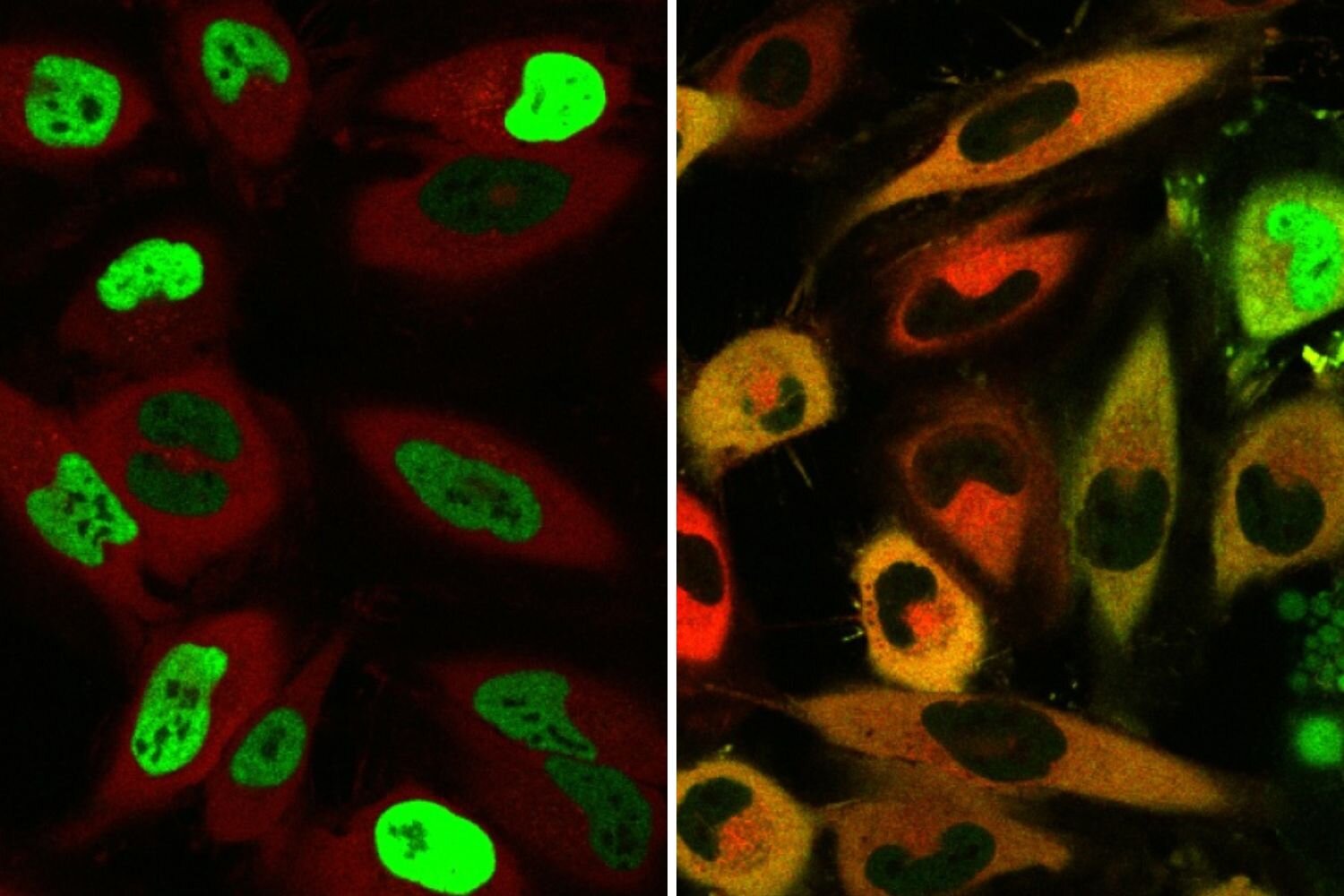
Zellen vor und nach der Einführung von TRAMs. TRAMs binden ein Shuttle-Protein (rot) und ein Zielprotein (grün). Ohne TRAM befindet sich das Zielprotein im Zellkern (links) und bei TRAM-Behandlung wird das Zielprotein vom Pendelprotein in das Zytoplasma gezogen (rechts). Bildnachweis: Steven Banik und Christine Ng
Zellen sind streng kontrollierte Räume, die davon abhängen, dass sich jedes Protein am richtigen Ort befindet. Viele Krankheiten, darunter Krebs und neurodegenerative Erkrankungen, werden mit falsch platzierten Proteinen in Verbindung gebracht. Bei einigen Krebsarten beispielsweise wird ein Protein, das normalerweise die DNA-Replikation im Zellkern überwacht, von der DNA, die es überwachen soll, weggeschickt, wodurch Krebsarten wachsen können.
Steven Banik, Assistenzprofessor für Chemie an der Fakultät für Geistes- und Informationswissenschaften und Forscher am Sarafan ChEM-H Institute der Stanford University, und sein Labor haben eine neue Methode entwickelt, um verdrängte Proteine dazu zu zwingen, an ihren Platz in den Zellen zurückzukehren. Bei der Methode wird die Aktivität natürlicher Shuttles neu verdrahtet, um den Transport von Proteinen zu verschiedenen Teilen der Zelle zu unterstützen. Das Team entwarf eine neue Klasse von Molekülen namens „Targeted Relocalization Activator Molecules“ (TRAMs), die diese natürlichen Shuttles dazu bringen, eine andere Ladung mitzunehmen, beispielsweise Proteine, die bei bestimmten Krebsarten aus dem Zellkern exportiert werden. Veröffentlicht in Natur Am 18. September könnte diese Strategie zu einer Therapie führen, um die mit Krankheiten verbundenen Fehlpositionierungen von Proteinen zu korrigieren und auch neue Funktionen in Zellen zu schaffen.
„Wir sammeln das verlorene Protein und bringen es nach Hause“, sagte Banik.
Shuttles und Passagiere
Unsere Zellen enthalten viele Kompartimente, wie zum Beispiel den Zellkern, den sicheren Hafen für die DNA, oder die Mitochondrien, in denen Energie produziert wird. Zwischen all diesen Kompartimenten befindet sich das Zytoplasma. Überall an den vielen Stellen der Zelle befinden sich Proteine. Sie sind für alle Arten von Aktionen verantwortlich (Aufbau und Abbau von Molekülen, Kontraktion von Muskeln, Senden von Signalen), aber um richtig zu funktionieren, müssen sie ihre jeweiligen Aktionen am richtigen Ort ausführen.
„Zellen sind sehr geschäftige Orte“, erklärt Banik. „Proteine bewegen sich durch die Menge und passieren dabei alle möglichen anderen Moleküle wie RNA, Lipide und andere Proteine. Die Funktion eines Proteins wird daher durch seine Leistungsfähigkeit und seine Nähe zu anderen Molekülen begrenzt. »
Manchmal machen sich Krankheiten dieses Bedürfnis nach Nähe zunutze, indem sie Proteine mutieren, die eine Zelle sonst vor Schäden schützen könnten. Diese Art von Mutation ist, als würde man auf einer Verpackung die falsche Adresse anbringen, was dazu führt, dass Proteine dorthin gelangen, wo sie in gesunden Zellen niemals hingehen würden.
Manchmal verhindert diese Bewegung, dass das Protein überhaupt funktioniert. Proteine, die beispielsweise auf die DNA einwirken, finden keine DNA im Zytoplasma und fliegen weg, ohne etwas zu tun. In anderen Fällen führt diese Bewegung dazu, dass ein Protein zu einem schlechten Akteur wird. Bei ALS beispielsweise schickt eine Mutation ein bestimmtes Protein namens FUS aus dem Zellkern in das Zytoplasma, wo es sich zu toxischen Klumpen zusammenklumpt und schließlich die Zelle abtötet.
Banik und sein Team fragten sich, ob sie dieser absichtlichen Proteinbewegung entgegenwirken könnten, indem sie andere Proteine als Shuttles nutzen, um die Passagierproteine an ihr Ziel zu transportieren. Da diese Shuttles jedoch oft noch andere Funktionen haben, musste das Team das Shuttle davon überzeugen, die Fracht aufzunehmen und an einen neuen Standort zu transportieren.
Zu diesem Zweck entwickelten Banik und sein Team einen neuen Typ eines zweiköpfigen Moleküls namens TRAM. Ein Kopf ist so konzipiert, dass er am Shuttle haftet, der andere am Passagier. Wenn das Shuttle stark genug ist, transportiert es den Passagier an seiner Stelle.
Auf dem Weg zur Reise
Das Team konzentrierte sich auf zwei Arten vielversprechender Shuttles: eines, das Proteine in den Zellkern befördert, und eines, das Proteine aus dem Zellkern exportiert. Christine Ng, eine Doktorandin der Chemie und Erstautorin der Arbeit, entwarf und baute Straßenbahnen, die Shuttle und Passagiere verbinden. Wenn ein Passagier aus dem Zytoplasma im Zellkern landet, weiß er, dass sein TRAM funktioniert hat.
Die erste Herausforderung war unmittelbar: Es gab keine zuverlässige Methode, um die Menge eines Proteins an einer bestimmten Stelle in einzelnen Zellen zu messen. Ng entwickelte daher eine neue Methode, um die Menge und Position von Passagierproteinen in einer Zelle zu einem bestimmten Zeitpunkt zu quantifizieren. Als ausgebildete Chemikerin musste sie sich dazu neue Fähigkeiten in der Mikroskopie und Computeranalyse aneignen.
„Die Natur ist von Natur aus komplex und vernetzt, daher ist es wichtig, interdisziplinäre Ansätze zu verfolgen“, sagte Ng. „Das Ausleihen von Logik oder Werkzeugen aus einem Bereich zur Lösung eines Problems in einem anderen Bereich führt oft zu sehr interessanten Fragen und Entdeckungen. »
Anschließend stellte sie das System auf die Probe. Seine TRAMs transportierten Passagierproteine erfolgreich in den Kern hinein und aus ihm heraus, abhängig vom verwendeten Shuttle. Diese frühen Experimente halfen ihr, einige grundlegende „Regeln“ für das Design zu entwickeln, beispielsweise wie viel Widerstand ein Shuttle haben sollte, um die Tendenz des Passagiers, in eine andere Richtung zu ziehen, zu überwinden.
Die nächste Herausforderung bestand darin, TRAMs zu entwickeln, die Medikamente sein könnten, also die Bewegung krankheitsverursachender Proteine umkehren könnten. Sie entwickelten zunächst ein TRAM, das FUS, das Protein, das aus dem Zellkern verdrängt wird und bei ALS-Patienten gefährliche Granula bildet, neu lokalisieren würde. Nach der Behandlung der Zellen mit ihrem TRAM stellte das Team fest, dass FUS zu seinem Ursprungsort, dem Zellkern, transportiert wurde, toxische Klumpen abnahmen und die Wahrscheinlichkeit des Absterbens der Zellen geringer war.
Anschließend richteten sie ihre Aufmerksamkeit auf eine bekannte Mutation bei Mäusen, die sie resistenter gegen Neurodegeneration macht. Diese Mutation, die insbesondere vom inzwischen verstorbenen Ben Barres untersucht wurde, bewirkt die Bewegung eines bestimmten Proteins vom Zellkern zum Axon von Neuronen.
Das Team fragte sich, ob es möglich sei, ein TRAM zu schaffen, das die Schutzwirkung der Mutation nachahmt und das Protein an das Ende des Axons transportiert. Ihr TRAM bewegte nicht nur das Zielprotein entlang des Axons, sondern machte die Zelle auch widerstandsfähiger gegen Stress, der eine Neurodegeneration nachahmt.
In all diesen Beispielen stand das Team vor einer anhaltenden Herausforderung: Es ist schwierig, den TRAM-Kopf so zu gestalten, dass er auf Passagiere abzielt, da die Wissenschaftler noch nicht alle Moleküle identifiziert haben, die an ihre Zielpassagiere binden könnten. Um dieses Problem zu umgehen, nutzte das Team genetische Werkzeuge, um an diesen Passagieren eine Klebemarke anzubringen. Sie hoffen jedoch, in Zukunft natürliche klebrige Teile dieser Passagiere finden und TRAMs zu neuartigen Medikamenten weiterentwickeln zu können.
Obwohl sie sich auf zwei Shuttles konzentrierten, ist die Methode auf alle anderen Shuttles übertragbar, beispielsweise auf solche, die Objekte an die Zelloberfläche schieben, wo die Kommunikation mit anderen Zellen stattfindet.
Und das Team hofft, dass TRAMs nicht nur mutierte Proteine dorthin zurückschicken, wo sie hingehören, sondern auch, gesunde Proteine in Teile der Zelle zu schicken, auf die sie normalerweise keinen Zugriff haben, und so neue Funktionen zu schaffen, von denen wir noch nicht wissen, ob sie möglich sind.
„Es ist aufregend, weil wir gerade erst anfangen, die Regeln zu verstehen“, sagte Banik. „Wenn wir das Gleichgewicht ändern, wenn ein Protein zu einem anderen Zeitpunkt plötzlich Zugang zu neuen Molekülen in einem neuen Teil der Zelle hat, was wird es dann tun? Welche Funktionen könnten wir freischalten? Welchen neuen Teil der Biologie könnten wir verstehen? »
Weitere Informationen:
Christine SC Ng et al, Gezielte Proteinrelokalisierung durch Kopplung an den Proteintransport, Natur (2024). DOI: 10.1038/s41586-024-07950-8
Zur Verfügung gestellt von der Stanford University
Zitat:Neue Methode entwickelt, um verlegte Proteine in Zellen zu verlagern (2024, 21. September), abgerufen am 21. September 2024 von https://phys.org/news/2024-09-method-relocate-misplaced-proteins-cells.html
Dieses Dokument unterliegt dem Urheberrecht. Mit Ausnahme der fairen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient ausschließlich Informationszwecken.