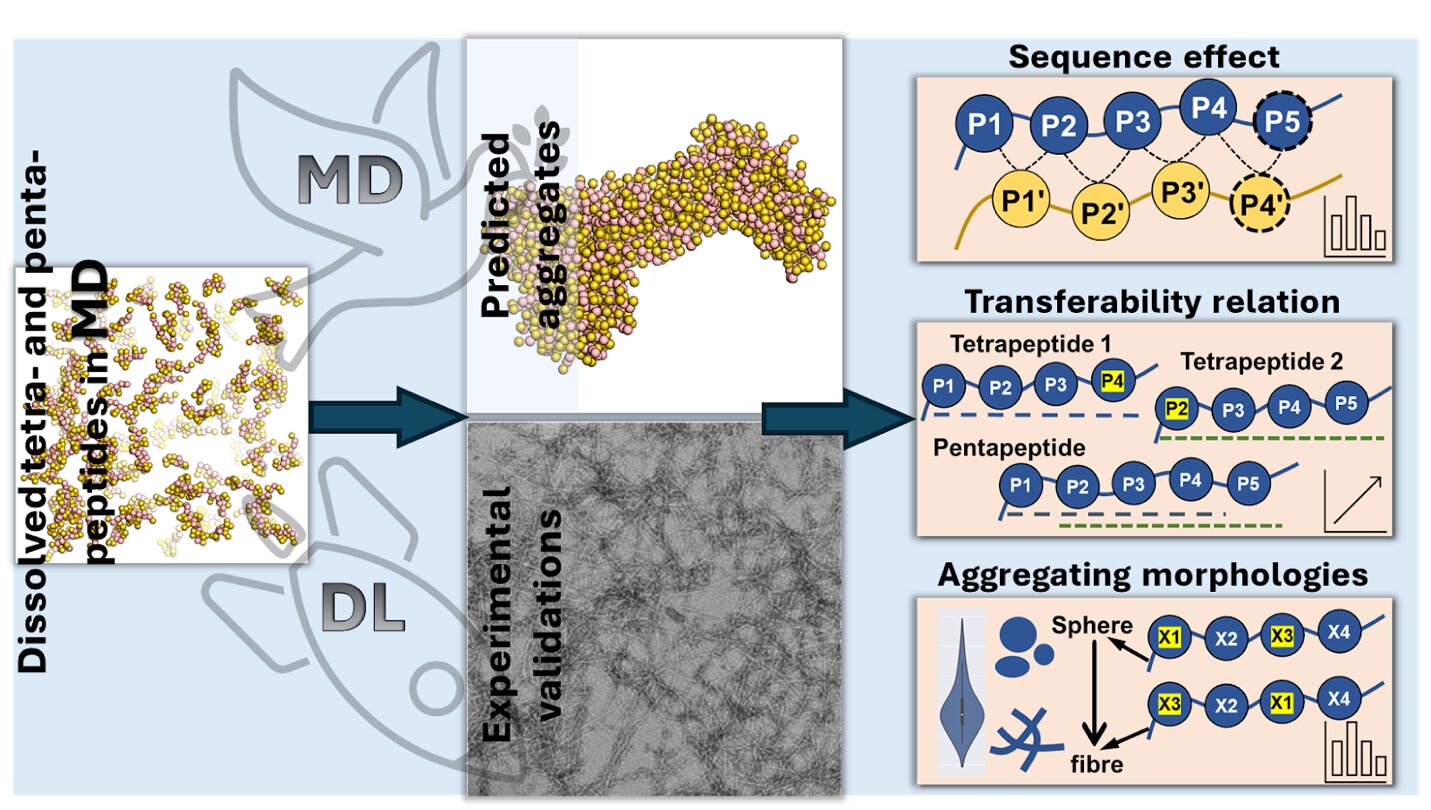
Mithilfe von Computersimulationen und fortschrittlicher KI wurde die Aggregation von Peptiden untersucht und vorhergesagt, was neue Einblicke in deren Verhalten und Struktur lieferte. Kredit : JACS Au/XJTLU
Chinesische Wissenschaftler haben untersucht, wie sich kurze Peptidketten zusammenlagern, um unser Verständnis des für die Arzneimittelstabilität und Materialentwicklung entscheidenden Prozesses zu vertiefen.
Ihre Studie, veröffentlicht in JACS Auliefert wertvolle Informationen darüber, wie kurze Proteine, sogenannte Peptide, interagieren, sich falten und funktionieren. Diese Erkenntnisse haben wichtige Auswirkungen auf die Medizin, die Materialwissenschaften und die Biotechnologie.
Peptide sind kurze Aminosäureketten, die eine wesentliche Rolle im Körper spielen, indem sie Strukturen aufbauen, chemische Reaktionen beschleunigen und unser Immunsystem unterstützen. Die spezifische Funktion eines Proteins wird dadurch bestimmt, wie seine Aminosäuren miteinander interagieren und sich zu einer dreidimensionalen Struktur zusammenlagern.
Das Forschungsteam nutzte Molekulardynamiksimulationen zusammen mit fortschrittlichen KI-Techniken, darunter Deep-Learning-Modelle wie Transformer Regression Networks, um vorherzusagen, wie verschiedene Peptide aus vier oder fünf Aminosäuren (Tetrapeptide bzw. Pentapeptide) entsprechend ihrer Aminosäuresequenz aggregieren würden.
Durch die Analyse von 160.000 Tetrapeptiden und 3,2 Millionen Pentapeptiden entdeckten sie, dass bestimmte Aminosäuren, insbesondere aromatische wie Tryptophan, Phenylalanin und Tyrosin, die Aggregation deutlich verstärken, insbesondere wenn sie sich an einem Ende (dem C-Terminus) der Peptidkette befinden.
Dies ist wahrscheinlich darauf zurückzuführen, dass aromatische Aminosäuren ringförmige Strukturen haben, die sich durch ihre Elektronenwolken, die normalerweise als „π-π“-Wechselwirkungen bezeichnet werden, gegenseitig anziehen, was ihnen hilft, zusammenzuklumpen. Im Gegensatz dazu hemmen hydrophile Aminosäuren wie Asparaginsäure und Glutaminsäure die Aggregation aufgrund der starken Wechselwirkung mit Wassermolekülen, die verhindert, dass Peptide aneinander haften.
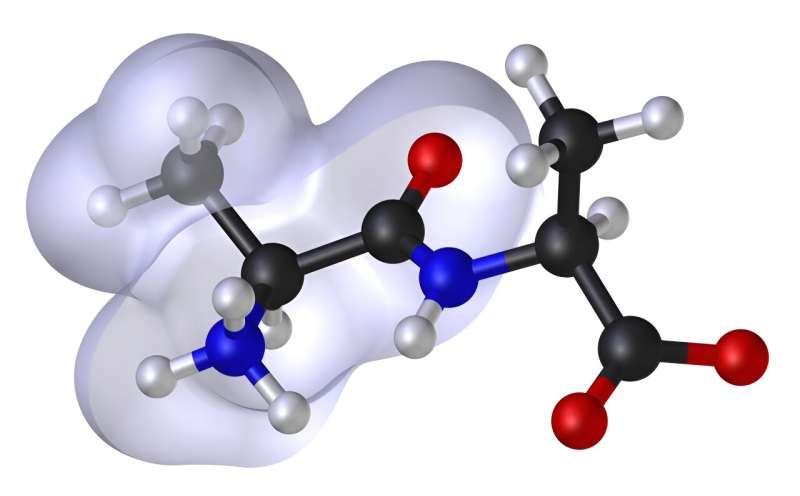
3D-Darstellung eines molekularen Modells. Das Molekül ist ein Alaninpeptid. Der Schleier stellt den Bereich der hydrophoben Abstoßung dar, wobei die Stärke des hydrophoben Effekts ungefähr proportional zur Oberfläche des Schleiers ist. Der Schleier erstreckt sich nur auf der Rückseite des Moleküls und erstreckt sich rundherum. Dieses Diagramm kann verwendet werden, um die Änderung der potentiellen Energie zu veranschaulichen, wenn sich Bindungen rotatorisch, winkelmäßig oder translatorisch bewegen. Bildnachweis: Abgeleitete Arbeit: Dhatfield (Diskussion)MM_PEF.svg: Edboas, CC BY-SA 3.0, über Wikimedia Commons
Die Studie zeigte auch, dass eine Änderung der Aminosäuresequenz die Aggregation beeinflusst. Beispielsweise erhöht das Hinzufügen aromatischer Aminosäuren am Ende der Peptidkette die Aggregation, während das Anbringen negativ geladener Aminosäuren am Anfang sie verringert. Das Team entdeckte außerdem, dass Peptide je nach Art und Position ihrer Aminosäuren in unterschiedlichen Formen zusammenklumpen.
„Geladene Aminosäuren bewirken im Allgemeinen, dass Peptide lange, fadenförmige Strukturen bilden, während diejenigen, die Wasser meiden, dazu neigen, runde, kugelförmige Cluster zu bilden“, sagt Dr. Wenbin Li, Assistenzprofessor an der Westlake University und korrespondierender Autor des Buches Studie.
„Wir haben auch herausgefunden, dass wir durch das Verständnis, wie Tetrapeptide aneinander haften, das Verhalten von Pentapeptiden vorhersagen können, was es einfacher macht, vorherzusagen, wie lange Peptide zusammenklumpen werden.“ »
Die Ergebnisse liefern wichtige Leitlinien für die Vorhersage und Steuerung der Peptidaggregation.
„Dieses Wissen könnte dazu beitragen, neue Materialien zu entwickeln, stabilere Arzneimittel und Arzneimittelverabreichungssysteme zu entwickeln und Krankheiten zu verstehen, die mit der Peptidaggregation zusammenhängen, wie etwa die Alzheimer-Krankheit, bei der Beta-Peptid-verklumpte Amyloide schädliche Plaques im Gehirn bilden“, sagt Dr. Jiaqi Wang , Assistenzprofessor an der Xi’an Jiaotong University-Liverpool (XJTLU) und Erstautor der Studie.
„Es kann auch die Biotechnologie wie Halbleiter, Biosensoren und Diagnostik verbessern, indem es sicherstellt, dass diese Werkzeuge präzise und konsistent funktionieren.
„Durch die Bereitstellung neuer Einblicke in die Peptidaggregation wird erwartet, dass diese Forschung die Biochemie, Materialwissenschaften und Computerbiologie voranbringt.“ Es zeigt auch die Integration von KI in die wissenschaftliche Entdeckung. Diese Fortschritte könnten zu Durchbrüchen bei medizinischen Behandlungen, umweltfreundlichen Produkten und innovativen Technologien führen. »
Weitere Informationen:
Jiaqi Wang, Zihan Liu, Shuang Zhao, Yu Zhang, Tengyan Xu, Stan Z. Li, Wenbin Li. Aggregationsregeln für kurze Peptide JACS Au (2024). DOI: 10.1021/jacsau.4c00501. pubs.acs.org/doi/10.1021/jacsau.4c00501
Bereitgestellt von der Xi’an Jiaotong-Universität Liverpool
Zitat:Erforschung der Peptidklumpung zur Verbesserung von Arzneimittel- und Materiallösungen (3. September 2024), abgerufen am 3. September 2024 von https://phys.org/news/2024-09-exploring-peptide-clumping-drug-material
Dieses Dokument unterliegt dem Urheberrecht. Mit Ausnahme der fairen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient ausschließlich Informationszwecken.