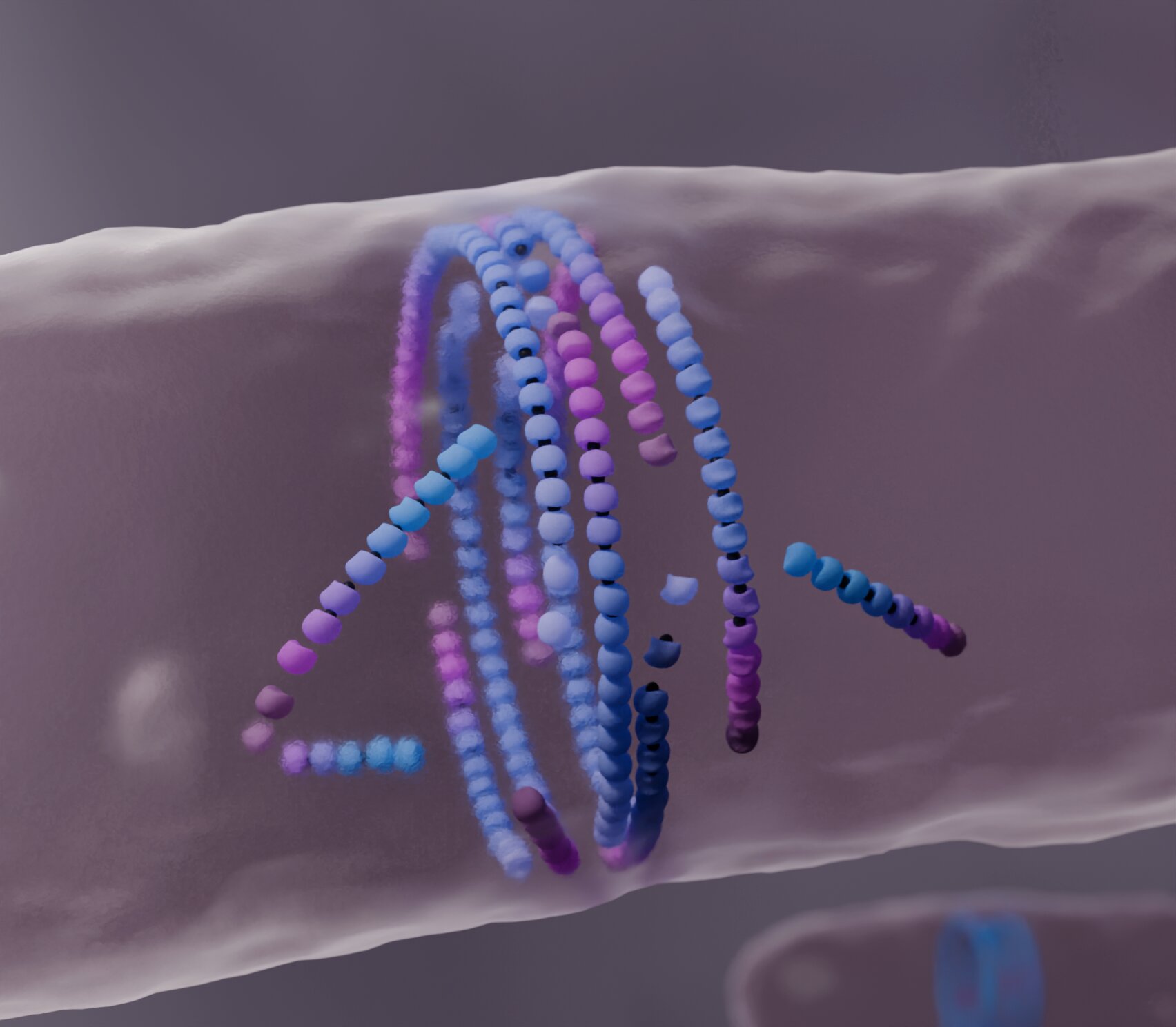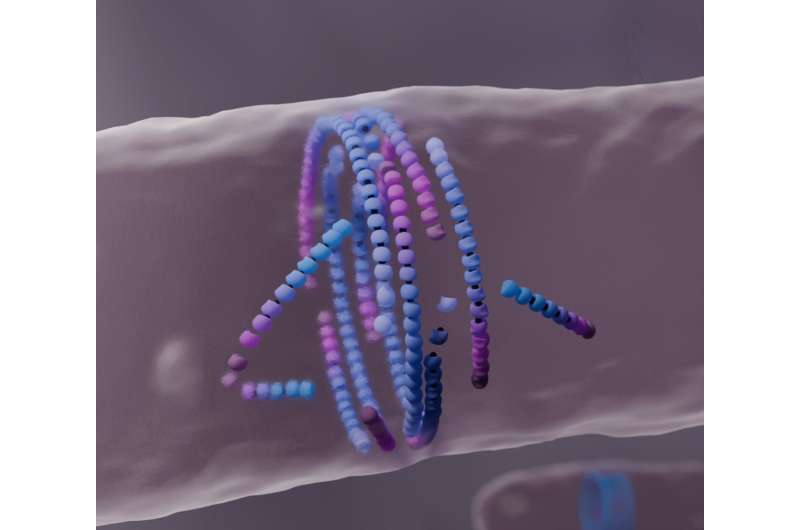
Computersimulation der Anordnung von Filamenten zu einem Teilungsring in der Mitte der Zelle. Bildnachweis: Nicola de Mitri
Ein bisher unbekannter Mechanismus der Selbstorganisation des für die Zellteilung von Bakterien wesentlichen aktiven Materials folgt dem „Die to align“-Prinzip: Fehlausgerichtete Filamente „sterben“ spontan ab und bilden eine ringförmige Struktur im Zentrum der sich teilenden Zelle. Die von der Šarić-Gruppe am Institute of Science and Technology Austria (ISTA) geleitete Studie wurde in veröffentlicht NaturphysikDiese Arbeit könnte bei der Entwicklung selbstheilender synthetischer Materialien Anwendung finden.
Wie organisiert sich Materie, die per Definition träge ist, selbst und macht uns lebendig? Eines der Kennzeichen des Lebens, die Selbstorganisation, ist die spontane Bildung und Zersetzung aktiver biologischer Materie. Da sich Moleküle jedoch ständig in das Leben hinein- und wieder herausbewegen, könnte man sich fragen, woher sie „wissen“, wo, wann und wie sie sich zusammensetzen und wann sie anhalten und auseinanderfallen müssen.
Forscher des Austrian Institute of Science and Technology (ISTA) unter der Leitung von Professorin Anđela Šarić und Doktorand Christian Vanhille Campos untersuchen diese Fragen im Kontext der bakteriellen Zellteilung. Sie entwickelten ein Computermodell für den Aufbau eines Proteins namens FtsZ, einem Beispiel für ein aktives Material.
Während der Zellteilung baut sich FtsZ selbst zu einer ringförmigen Struktur im Zentrum der sich teilenden Bakterienzelle auf. Es wurde festgestellt, dass dieser FtsZ-Ring, der als bakterieller Teilungsring bezeichnet wird, dabei hilft, eine neue „Wand“ zu bilden, die Tochterzellen trennt. Allerdings wurden die wesentlichen physikalischen Aspekte der FtsZ-Selbstorganisation bisher nicht erklärt.
Heute arbeiten Computermodellierer der Šarić-Gruppe mit Experimentatoren der Gruppe von Séamus Holden an der University of Warwick, Großbritannien, und der Gruppe von Martin Loose am ISTA zusammen, um einen unerwarteten Mechanismus zu enthüllen. Ihre Rechenarbeit zeigt, wie falsch ausgerichtete FtsZ-Filamente reagieren, wenn sie auf ein Hindernis treffen.
Indem sie „absterben“ und sich wieder zusammensetzen, fördern sie die Bildung des bakteriellen Teilungsrings, einer gut ausgerichteten filamentösen Struktur. Diese Ergebnisse könnten bei der Entwicklung selbstheilender synthetischer Materialien Anwendung finden.
Das Laufband, die adaptive Kraft der molekularen Erneuerung
Das FtsZ-Protein bildet Proteinfilamente, die sich durch kontinuierliches Wachsen und Schrumpfen selbst zusammensetzen. Dieser als „Treadmilling“ bezeichnete Prozess beinhaltet das ständige Hinzufügen und Entfernen von Untereinheiten an gegenüberliegenden Enden der Filamente. Es wurde gezeigt, dass mehrere Proteine in verschiedenen Lebensformen wie Bakterien, Tieren und Pflanzen als Tretmühlen fungieren.
Wissenschaftler haben das Laufband zuvor als eine Form des Selbstantriebs betrachtet und es als vorwärtsbewegende Filamente modelliert. Allerdings gelingt es diesen Modellen nicht, den ständigen Wechsel der Untereinheiten zu erfassen und die durch die Filamentanordnung erzeugten Kräfte zu überschätzen. Deshalb machten sich Anđela Šarić und ihr Team daran, zu modellieren, wie FtsZ-Untereinheiten beim Treten interagieren und spontan Filamente bilden.
„In unseren Zellen entwickelt sich alles ständig weiter. Wir müssen also anfangen, über aktive biologische Materie aus dem Prisma des molekularen Umsatzes nachzudenken und auf eine Art und Weise, die sich an die äußere Umgebung anpasst“, erklärt Šarić.
Sterbliche Filamente: Würfel zum Ausrichten
Was sie entdeckten, war verblüffend. Im Gegensatz zu selbstfahrenden Baugruppen, die umliegende Moleküle anschieben und bei großen Molekülabständen einen spürbaren „Beulen“ erzeugen, stellten sie fest, dass falsch ausgerichtete FtsZ-Filamente zu „sterben“ begannen, wenn sie auf ein Hindernis trafen.
„Das aktive Material aus tödlichen Filamenten nimmt Fehlausrichtungen nicht auf die leichte Schulter. Wenn ein Filament wächst und mit Hindernissen kollidiert, löst es sich auf und stirbt“, erklärt Erstautorin Vanhille Campos.
Šarić fügt hinzu: „Unser Modell zeigt, dass Laufbandanordnungen zu einer lokalen Heilung des aktiven Materials führen. Wenn falsch ausgerichtete Filamente absterben, tragen sie zu einer besseren Gesamtmontage bei. »
Durch die Einbeziehung der Zellgeometrie und der Filamentkrümmung in ihr Modell zeigten sie, wie das Absterben falsch ausgerichteter FtsZ-Filamente zur Bildung des bakteriellen Teilungsrings beitrug.
Theoriebasierte Forschung, bestätigt durch die Zusammenarbeit mit Experimentatoren
Motiviert durch physikalische Theorien molekularer Wechselwirkungen trafen sich Šarić und sein Team schnell zu zwei unabhängigen Treffen mit experimentellen Gruppen, die zur Bestätigung ihrer Ergebnisse beitrugen. Auf einer vielfältigen, multidisziplinären Konferenz mit dem Titel „Physics Meets Biology“ trafen sie Holden, der an der Bildgebung der Bildung von Bakterienringen in lebenden Zellen arbeitete.
Bei diesem Treffen präsentierte Holden interessante experimentelle Daten, die zeigten, dass der Tod und die Geburt von FtsZ-Filamenten für die Bildung des Teilungsrings wesentlich waren. Dies deutete darauf hin, dass das Laufband in diesem Prozess eine entscheidende Rolle spielte.
„Wir waren erfreut zu sehen, dass sich die FtsZ-Ringe in unseren Simulationen ähnlich verhielten wie die Teilungsringe von Bacillus subtilis, die Holdens Team abgebildet hatte“, sagt Vanhille Campos.
Durch einen ähnlichen Glücksfall konnten Šarić und seine Gruppe durch den Wechsel vom University College London zum ISTA mit Martin Loose zusammenarbeiten, der an der Montage von FtsZ-Filamenten in einem kontrollierten Versuchsaufbau in vitro arbeitete. Sie fanden heraus, dass die In-vitro-Ergebnisse weitgehend mit den Simulationen übereinstimmten und bestätigten die Berechnungsergebnisse des Teams.
Šarić betont den Geist der Zusammenarbeit und Synergie zwischen den drei Gruppen und sagt: „Wir verlassen alle unsere üblichen Forschungsbereiche und gehen über das hinaus, was wir normalerweise tun.“ Wir diskutieren und teilen Daten, Perspektiven und Wissen offen und können so Fragen beantworten, die wir nicht einzeln beantworten können. »
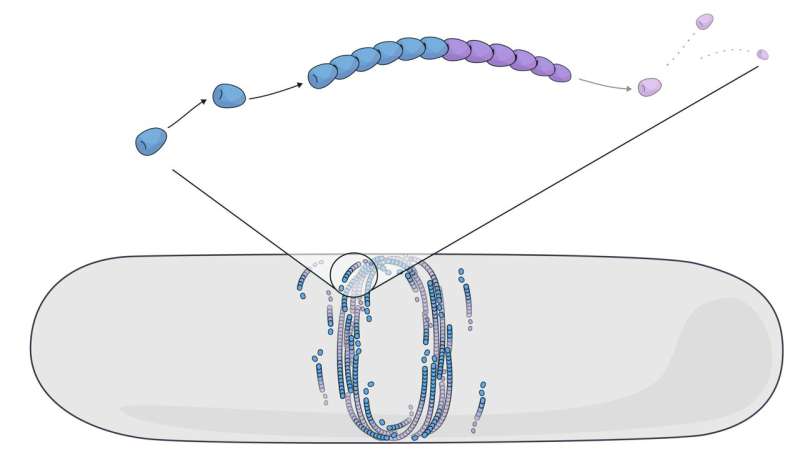
Simulation der Selbstorganisation von FtsZ-Filamenten durch Laufband. Die Modellierung des Laufbands von FtsZ-Filamenten in einer Bakterienzelle zeigt, wie der bakterielle Teilungsring gebildet wird. Bildnachweis: Claudia Flandoli
Auf dem Weg zu selbstheilenden synthetischen Materialien
Die durch Energie erzeugte Selbstorganisation von Materie ist ein grundlegender Prozess der Physik. Das von Šarić geleitete Team schlägt nun vor, dass FtsZ-Filamente eine weitere Art von aktivem Material sind, das Energie eher in den Umsatz als in die Beweglichkeit investiert.
„In meiner Gruppe fragen wir uns, wie man aus inerten Materialien, die lebendig erscheinen, lebende Materie erschaffen kann. Somit könnte unsere aktuelle Arbeit die Schaffung selbstheilender synthetischer Materialien oder synthetischer Zellen erleichtern“, erklärt Šarić.
Als nächsten Schritt wollen Šarić und sein Team modellieren, wie der bakterielle Teilungsring beim Aufbau einer Wand hilft, die die Zelle in zwei Teile teilt.
Weitere Informationen:
Selbstorganisation tödlicher Filamente und ihre Rolle bei der Bildung bakterieller Teilungsringe, Naturphysik (2024). DOI: 10.1038/s41567-024-02597-8
Bereitgestellt vom Österreichischen Institut für Wissenschaft und Technologie
Zitat: Ausrichten oder sterben: Aufdeckung eines unbekannten Mechanismus, der für die Zellteilung von Bakterien essentiell ist (2024, 12. August), abgerufen am 12. August 2024 von https://phys.org/news/2024-08-align-die-revealing-unknown -mechanism. html
Dieses Dokument unterliegt dem Urheberrecht. Mit Ausnahme der fairen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient ausschließlich Informationszwecken.