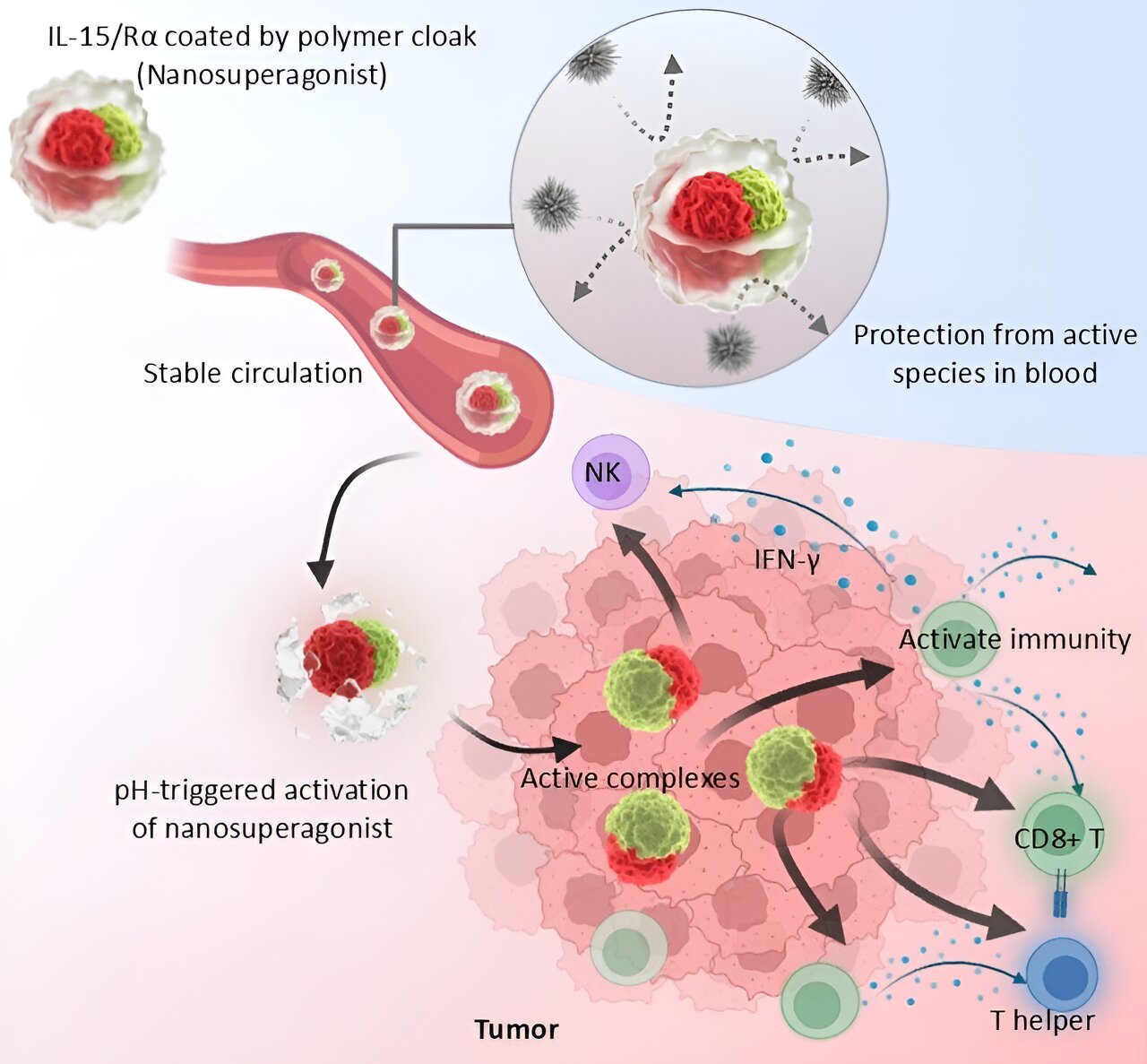
Wirkungsweise des Nanosuperagonisten. Bildnachweis: Horacio Cabral
Eine Gruppe um Professor Horacio Cabral hat eine neue Methode zum Aufbau von Therapien auf Basis von Proteinkomplexen entdeckt.
Professor Cabral ist Gastwissenschaftler am Innovation Center for Nanomedicine (iCONM) und außerordentlicher Professor am Department of Bioengineering der Graduate School of Engineering der Universität Tokio.
Der Artikel mit dem Titel „Nanoaktivierter IL-15-Superagonist über bedingt stabilisierte Protein-Protein-Interaktionen beseitigt solide Tumoren durch präzise Immunmodulation“ wurde im veröffentlicht Zeitschrift der American Chemical Society am 2. Oktober 2024.
Proteinkomplexe sind wesentliche Regulatoren verschiedener biologischer Prozesse und weisen einzigartige Funktionen auf, die sie zu vielversprechenden Kandidaten für therapeutische Anwendungen machen. Beispielsweise kann Interlukin-15 (IL-15) an seine α-Rezeptordomäne (IL-15Rα) binden und einen superagonistischen Komplex bilden, der die Antitumorimmunität wirksam aktivieren kann, indem er die IL-Transpräsentation an Immunzellen erleichtert.
Proteinkomplexe werden jedoch hauptsächlich durch dynamische nichtkovalente Wechselwirkungen gebildet, was zu Instabilität und vorübergehender effektiver Zeit in biologischen Umgebungen führt. Daher sind Abgabestrategien erforderlich, um eine stabile Abgabe von Proteinkomplexen sicherzustellen.
Die vorliegende Studie stellt eine Polymerhülle vor, die die Verwendung von Proteinkomplexen als therapeutische Wirkstoffe erleichtern soll, wie die Prototypformulierung zeigt, die den IL-15/IL-15Rα-Komplex enthält.
Die Polymerbeschichtung stabilisierte die Protein-Protein-Wechselwirkung zwischen IL-15 und IL-15Rα, wodurch der Komplex effektiv immobilisiert, von der Umgebung isoliert und ein IL-15-Nanosuperagonist mit erhöhter Effizienz erzeugt wurde. In Mausmodellen zeigte der Nanosuperagonist eine verbesserte Pharmakokinetik und lieferte den intakten Proteinkomplex bei intravenöser Injektion stabil.
Darüber hinaus könnte der Nanosuperagonist aufgrund der pH-Empfindlichkeit der Polymerhülle die saure Mikroumgebung des Tumors erkennen und eine selektive Tumoraktivierung gewährleisten. In Mausmodellen für Darmkrebs entzündete der Nanosuperagonist den Tumor tief, um Krebszellen zu eliminieren, ohne immunbedingte Nebenwirkungen hervorzurufen.
Wie in dieser Studie dargestellt, könnte der IL-15/IL-15Rα-Komplex durch externe reaktive Spezies wie monomeres IL-15 oder Proteasen zerstört werden, was zu einem schnellen Zerfall des Komplexes in vivo führt.
Im Gegensatz dazu blockierte die Polymerkappe den Komplex und schützte seine Integrität in rauen Umgebungen wie der Blutzirkulation. Somit könnte die Polymerhülle die Stabilität und Funktion des Proteinkomplexes unter In-vivo-Bedingungen fördern, was für die Erzielung einer therapeutischen Aktivität unerlässlich ist.
Im Vergleich zu bekannten Methoden zur Bereitstellung von Proteinkomplexen, bei denen der Schwerpunkt auf der Konstruktion von Proteinstrukturen zur Schaffung stabiler Fusionsproteine liegt, lenkt diese Polymerhülle die Komplexität von Design und Herstellung von der Protein-Engineering-Technologie ab.
Darüber hinaus kann das System problemlos erweitert werden, um es auf andere Proteinkomplex-Nutzlasten als den dargestellten IL-15/IL-15Rα-Komplex anzuwenden und als universelle Plattform zu dienen. Darüber hinaus sorgte das System aufgrund der pH-empfindlichen Beschaffenheit der Polymerhülle nicht nur für eine stabile systemische Freisetzung der intakten Proteinkomplexe, sondern ermöglichte auch eine tumorgezielte Freisetzung der Ladungen.
Im Fall des IL-15-basierten Nanosuperagonisten stabilisierte die Polymerbeschichtung den IL-15/IL-15Rα-Komplex, um eine Antitumor-Superagonistenwirkung zu erzielen, und die pH-kontrollierte Entfernung des Polymers ermöglichte eine tumorspezifische Bioaktivität, die die Toxizität verringerte .
Im Vergleich zu herkömmlichen IL-15-Superagonistenformulierungen auf Basis von Fusionsproteinen erzielte der Nanosuperagonist somit eine sicherere Therapie. Zusammenfassend stellt die Polymerhülle eine vereinfachte Plattform für die tumorzielgerichtete Abgabe von Proteinkomplexen dar und wird weitere Forschungen zu polymerbasierten und nanotechnologischen Ansätzen anregen, um die Umsetzung von Proteinkomplexen als therapeutische Wirkstoffe zu erleichtern.
Weitere Informationen:
Pengwen Chen et al., ein nanoaktivierter IL-15-Superagonist über bedingt stabilisierte Protein-Protein-Wechselwirkungen, beseitigt solide Tumoren durch präzise Immunmodulation. Zeitschrift der American Chemical Society (2024). DOI: 10.1021/jacs.4c08327
Unterstützt vom NanoMedicine Innovation Center
Zitat: Polymermantel stabilisiert Zytokinkomplex, um tumorzielgerichteten Nanosuperagonisten zu erzeugen (4. Oktober 2024), abgerufen am 4. Oktober 2024 von https://phys.org/news/2024-10-polymeric-cloak-stabilizes-cytokine-complex.html
Dieses Dokument unterliegt dem Urheberrecht. Mit Ausnahme der fairen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient ausschließlich Informationszwecken.