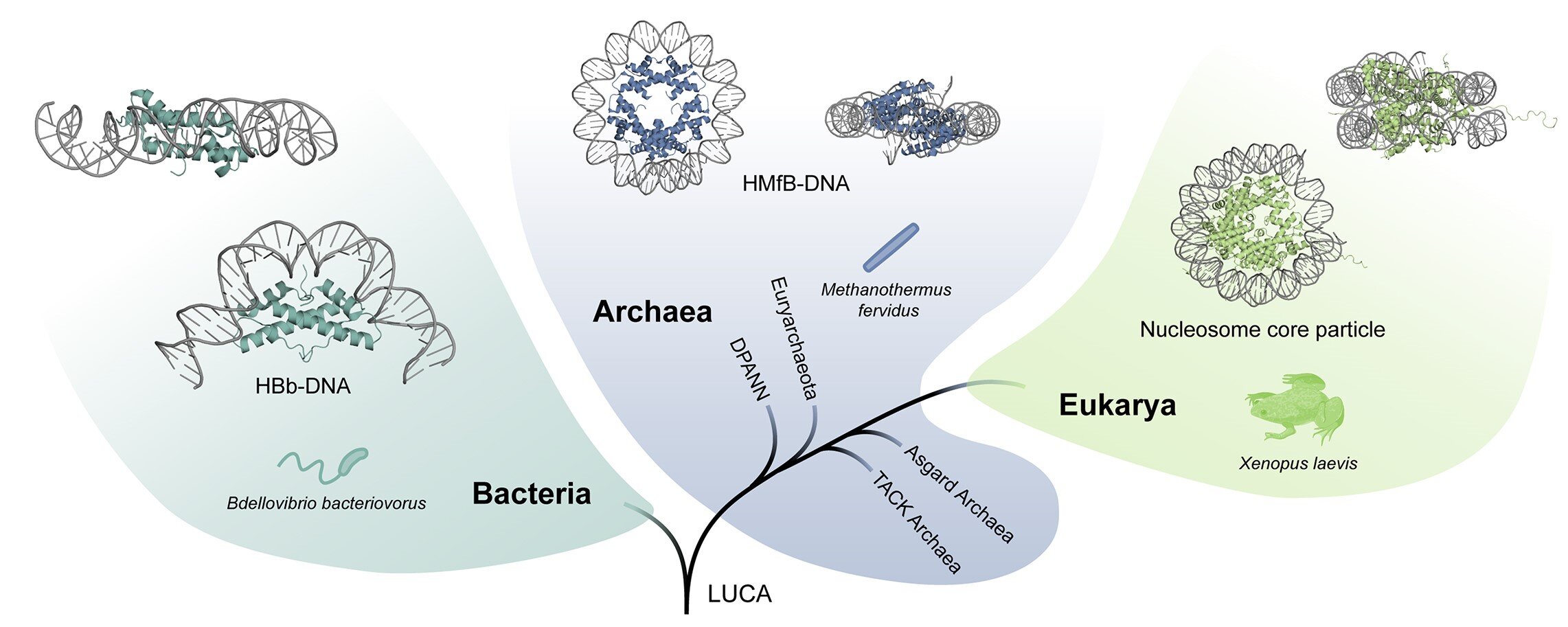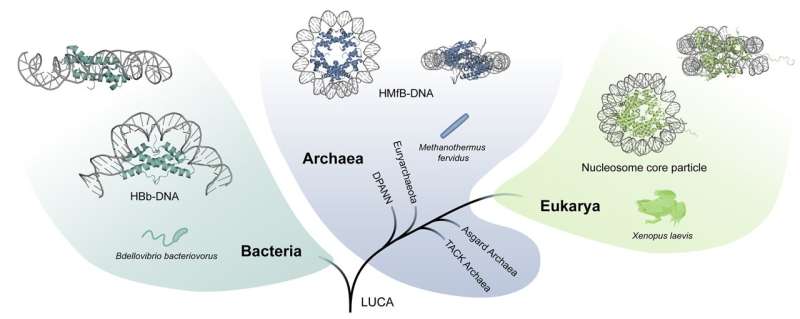
Die unterschiedliche Art und Weise, wie Bakterien, Archaeen und Eukaryoten ihre DNA organisieren, ist sehr unterschiedlich. Bildnachweis: Yimin Hu
Es stellt sich heraus, dass einige Bakterien über ähnliche Proteine wie wir verfügen, die die DNA in ihren Zellen organisieren. Sie machen es einfach ein bisschen anders. Das zeigen neue Forschungsergebnisse von Biochemikern des Leiden Institute of Chemistry und des Max-Planck-Instituts für Biologie. Diese Entdeckung hilft uns, besser zu verstehen, wie Bakterien ihre DNA organisieren, und liefert neue Einblicke in die Entwicklung dieser Proteintypen.
„Das passt nicht wirklich zusammen“, dachte Professor Remus Dame, als er die Veröffentlichung einer Gruppe von Forscherkollegen las. „Sie hatten eine Proteinstruktur gefunden, die der von meinen Kollegen Birte Hernandez Alvarez und Vikram Alva vom Max-Planck-Institut für Biologie in Tübingen, Deutschland, definierten ähnelte, die das Protein vor einigen Jahren ebenfalls entdeckten. Allerdings war die Art und Weise „, wie sie behaupteten dass dieses Protein an die DNA bindet, erschien mir sehr unlogisch.“
Sichere und sorgfältige DNA-Aufbewahrung
Dame und ihre Kollegen untersuchten eine bestimmte Art von Proteinen: Histone. Histone spielen eine entscheidende Rolle bei der Organisation der DNA in Zellen von Eukaryoten (Zellen mit Zellkern) und Archaeen (einzellige Organismen ohne Zellkern). Die Ergebnisse werden in der Zeitschrift veröffentlicht Nukleinsäureforschung.
Dame sagt: „DNA-Moleküle sind sehr lang und enthalten wichtige Informationen für die Zelle. Um DNA sicher und kompakt zu speichern, wickelt eine Zelle DNA-Stränge fest um „Kügelchen“ aus Histone. Durch gezieltes Drehen der DNA um diese Histonkügelchen kann die Zelle auch regulieren, welche Gene für die Transkription zugänglich sind, und so deren Expression regulieren.
„Das genaue Gegenteil von dem, was man erwarten würde“
Die andere Forschungsgruppe und Kollegen des Max-Planck-Instituts haben erstmals ein Histonprotein in einem Bakterium beschrieben. „Das hat es noch nie gegeben“, sagt Dame.
„Der Code und die Struktur der DNA sahen aus wie eine vereinfachte Version ‚unserer‘ menschlichen Histone. Die Frage war: Haben sie auch die gleiche Funktion?“
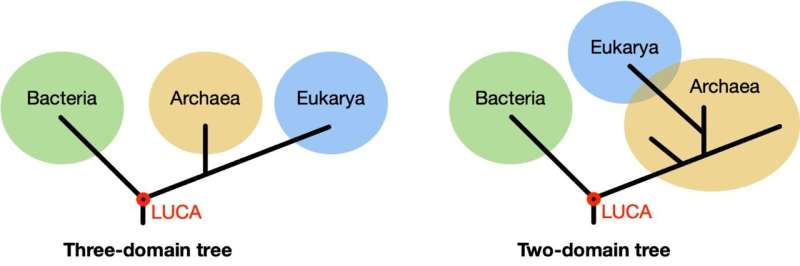
Die grundlegendsten Organismen auf der Erde sind Einzeller und haben keinen Zellkern. Erst um 1970 wurde entdeckt, dass diese Organismen zwei verschiedene Gruppen bilden, nämlich Bakterien und Archaeen. Auf den ersten Blick sehen sie ähnlich aus, ihre Biochemie unterscheidet sich jedoch grundlegend, weshalb wir sie als zwei getrennte Lebensbereiche betrachten. Ursprünglich wurden Organismen mit Zellen mit Zellkern, Eukaryoten, einschließlich des Menschen, in eine dritte Domäne eingeteilt. Jüngsten Erkenntnissen zufolge gibt es jedoch nur zwei Lebensbereiche und Eukaryoten gehören zu den Archaeen. Bildnachweis: Universität Leiden
Nach Angaben der konkurrierenden Gruppe ist dies nicht der Fall; Sie beschrieben ein Protein, das sich um bakterielle DNA wickelt und diese dann dehnt. Dame sagt: „[It’s] genau das Gegenteil von dem, was man erwarten würde. Deshalb habe ich unsere Kollegen in Deutschland kontaktiert. Yimin Hu, ein Ph.D. Der Doktorand am Max-Planck-Institut hat die Struktur des an die DNA gebundenen Proteins gelöst und wir konnten die Funktion des Proteins bestimmen. Und dann passte alles wunderbar zusammen. »
Dames Team führte umfangreiche biochemische Analysen und Einzelmolekülexperimente durch. Bei diesen Experimenten werden einzelne Moleküle untersucht und nicht große Mengen auf einmal. Dame sagt: „Damit konnten wir zeigen, dass dieses Protein genau das tut, was man erwarten würde: Es bindet auf ganz andere Weise an bakterielle DNA und macht sie kompakter.“ »
Dies geschieht jedoch anders als bei anderen Lebensformen. In Eukaryoten bilden Histone Strukturen, die aus acht Einheiten bestehen. Zusammen bilden sie eine Kugel aus Proteinen, um die sich die DNA wickelt. Dies kommt auch bei Archaeen vor, allerdings ist hier die Anzahl der Einheiten unendlich groß, es entstehen stabförmige Strukturen. Bei Bakterien stellt sich die Situation wiederum ganz anders dar: Die Proteine bilden zwei Einheiten, die die DNA nicht umhüllen, sondern kompakt falten.
Das Unsichtbare sichtbar machen
DNA ist zu klein, um mit bloßem Auge gesehen zu werden. Wie können wir also die Wirkung eines Proteins auf diese DNA untersuchen? Forscher haben eine einfache, aber geniale Methode entwickelt. Sie fügen Histonproteine zu einzelnen DNA-Strängen hinzu und beobachten, was passiert. Der Aufbau ist recht einfach: Ein Ende des DNA-Strangs ist an einer Glasplatte befestigt, während das andere Ende wie ein umgekehrtes Pendel frei im Wasser hängt. An diesem freien Ende ist eine Kunststoffperle befestigt, die man mit einem einfachen Mikroskop erkennen kann.
Da die Perlen an der Unterseite befestigt sind, ist ihre Bewegungsfreiheit eingeschränkt. Dann fügen Sie ein Protein hinzu. Doktorand Samuel Schwab erklärt: „Die Bewegung der Perlen verrät uns dann, was mit der DNA passiert.“ Wenn wir ein Protein hinzufügen, das die DNA kompakter macht, wie unser Histonprotein, sehen wir, dass sich die Kügelchen weniger bewegen. Länger würde man mehr Bewegung sehen. Auf diese Weise können Sie indirekt Informationen über die Funktion eines Proteins gewinnen.
Entsteht früh in der Evolution
Die Forschung verrät uns mehr darüber, wie Histone in Bakterien funktionieren, wirft aber auch neues Licht auf die frühe Entwicklung dieser entscheidenden Proteine. Die Tatsache, dass in einigen Bakterien bereits eine einfache Form von Histone existiert, lässt darauf schließen, dass sie schon früh in der Evolution auftraten. „Es ist schwer, es genau festzulegen“, sagt Dame.
„Aber unsere Entdeckung zeigt, dass bakterielle Histone eine frühe Grundform der komplexeren Proteinkügelchen sein könnten, die in Eukaryoten und Archaeen vorkommen. Selbst einfache Lebensformen nutzten offenbar bereits ausgefeilte Mechanismen, um ihre Gene zu verwalten. Auf diese Weise haben wir nach und nach begonnen Gewinnen Sie ein tieferes Verständnis der grundlegenden Ähnlichkeiten und Unterschiede zwischen Organismen in unserem Evolutionsbaum.
Mehr Informationen:
Yimin Hu et al., Das bakterielle Histon HBb von Bdellovibrio bacteriovorus verdichtet DNA durch Krümmung, Nukleinsäureforschung (2024). DOI: 10.1093/nar/gkae485
Zur Verfügung gestellt von der Universität Leiden
Zitat: Nicht verpacken, sondern falten: Auch Bakterien organisieren ihre DNA, aber sie machen es etwas anders (13. Juni 2024), abgerufen am 13. Juni 2024 von https://phys.org/news/2024-06-bacteria-dna-bit -anders.html
Dieses Dokument unterliegt dem Urheberrecht. Mit Ausnahme der fairen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient lediglich der Information.