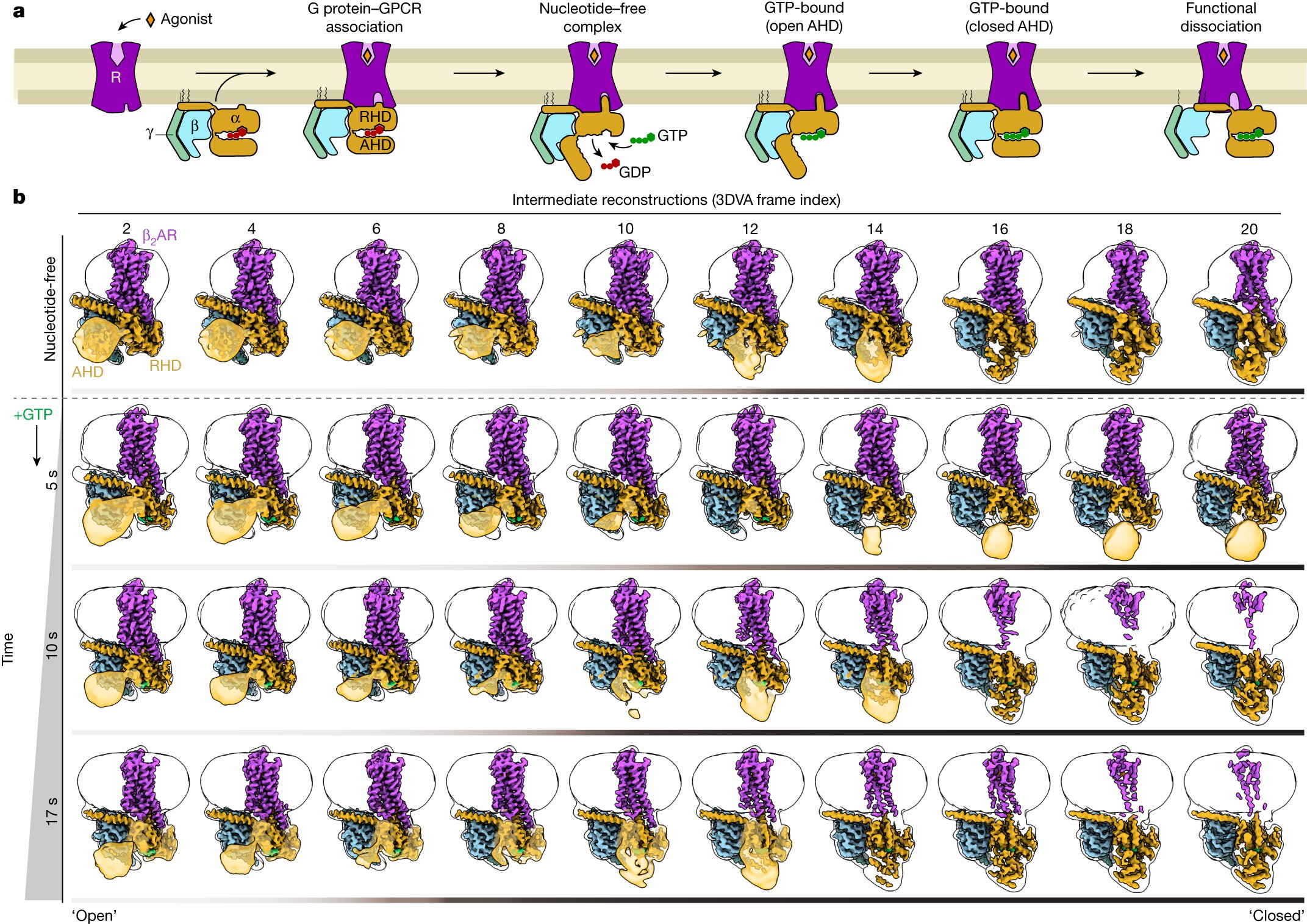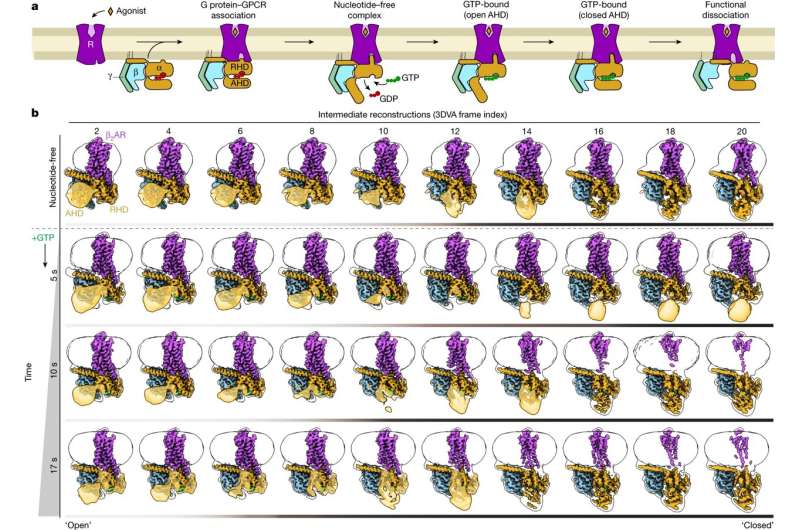
Konformationsdynamik während der G-Protein-Aktivierung. a, Als Reaktion auf die Agonistenbindung bindet ein GPCR das heterotrimere G-Protein über die C-terminale α5-Gα-Helix, was zu einer Verschiebung des Gα-AHD relativ zum RHD führt. Diese Öffnung ermöglicht die Freisetzung von gebundenem GDP und die anschließende Bindung von GTP, was zur Aktivierung der Gα-Untereinheit und der funktionellen Dissoziation von Gβγ von Gα führt. b, β2AR-Gs-Konformationsdynamik, ermittelt durch Kryo-EM. Die Komplexe wurden durch Vitrifikation im nukleotidfreien Zustand eingefangen. Mithilfe der 3DVA-Funktion von cryoSPARC wurden die Daten aufgeteilt, um 20 Rekonstruktionen der Hauptkomponente der Bewegung (d. h. AHD-Verschluss) zu erhalten. Aus Platzgründen werden nur gerade Zwischenwerte (Frame-Indizes) angezeigt. Die Komplexe wurden zu fortschreitenden Zeitpunkten nach der Zugabe von GTP zum nukleotidfreien Komplex (letzte drei Reihen) weiter eingefroren. Unter Verwendung des gleichen Behandlungsschemas zeigte die Dynamik des GTP-gebundenen Komplexes, dass der Anteil der Partikel mit einem geschlossenen AHD mit der Vitrifikationszeit nach der Zugabe von GTP zunahm. Die gezeigten Rekonstruktionen umfassen die verfeinerten Karten in Volltonfarbe, umgeben von der unscharfen Gauß-gefilterten Hülle, um die Mizelle und die Position des AHD (durchscheinendes Gold, außer bei direkter Beobachtung in der verfeinerten Karte) anzuzeigen. Die Farbbalken unter jeder Strukturbaugruppe sind schattiert, je nachdem, ob die AHD-Position „offen“ oder „geschlossen“ ist. Kredit: Natur (2024). DOI: 10.1038/s41586-024-07153-1
Einem internationalen Forscherteam ist es gelungen, die Aktivierung eines wichtigen Rezeptors zu „filmen“. Sie haben die beteiligten Moleküle zu unterschiedlichen Zeitpunkten eingefroren und unter einem Elektronenmikroskop fotografiert. Anschließend konnten sie diese Standbilder der Reihe nach anordnen. Diese Sequenz zeigt Schritt für Schritt, welche räumlichen Veränderungen der Empfänger bei Aktivierung erfährt.
Forscher der Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) waren maßgeblich an der Studie beteiligt. Die Ergebnisse wurden nun in der Fachzeitschrift veröffentlicht Naturkönnte mittelfristig zur Entwicklung wirksamerer Medikamente führen.
Zellen kommunizieren untereinander über Signalmoleküle, die sie mithilfe spezifischer Rezeptorstrukturen, sogenannter Rezeptoren, erkennen. Diese sind in der Zellmembran eingebettet, der dünnen Schicht, die die Zelle umgibt. Eine besonders wichtige Gruppe von Rezeptoren sind die sogenannten GPCRs.
Bindet sich an ihrer Außenseite ein geeignetes Signalmolekül an, wird eine komplexe Reaktionskette ausgelöst. Der Rezeptor verändert seine räumliche Struktur und aktiviert dadurch ein G-Protein im Inneren der Zelle, das an den Rezeptor gebunden ist. Dieses Protein bewegt sich weg und kann dann beispielsweise durch Diffusion zu einem Enzym in der Zelle pendeln, um dieses Enzym zu regulieren oder die Transkription bestimmter Gene zu aktivieren oder zu deaktivieren.
„Der Mensch verfügt über mehr als 800 GPCRs, von denen jeder auf die Erkennung eines bestimmten Signals spezialisiert ist“, erklärt Professor Peter Gmeiner, Inhaber des Lehrstuhls für Pharmazeutische Chemie an der FAU. „In unserer Studie haben wir uns auf einen bestimmten GPCR konzentriert, den β2-adrenergen Rezeptor. Er wird durch Adrenalin aktiviert und ist beispielsweise an der Regulierung der Herz- und Lungenfunktion beteiligt.“
Es ist daher auch ein wichtiger Ausgangspunkt für die Entwicklung von Medikamenten zur Behandlung von Asthma oder Herzinsuffizienz. „Dafür ist es jedoch wichtig, die Aktivierung des Rezeptors und des daran befestigten G-Proteins zu verstehen“, erklärt Gmeiner.
Die jetzt veröffentlichten Ergebnisse könnten einen wesentlichen Beitrag leisten. Dem internationalen Team um Georgios Skiniotis (Stanford University) mit Brian Kobilka (Stanford University), Peter Hildebrand (Universität Leipzig und Charité Berlin) und Peter Gmeiner gelang es, den Prozess der Rezeptoraktivierung Schritt für Schritt aufzuschlüsseln. Die Forscher verwendeten eine spezielle Methode, die sogenannte zeitaufgelöste kryogene Elektronenmikroskopie. Der Komplex aus Rezeptor und G-Protein wird kurz nach der Aktivierung bei -150 Grad eingefroren.
„Unter dem Mikroskop erhalten wir eine Reihe unterschiedlicher Bilder“, erklärt Gmeiner. „Anders, weil die Tausenden von Molekülen, die wir unter dem Mikroskop beobachten, nie ganz synchron sind. Aufgrund ihrer natürlichen Beweglichkeit sind einige in einem etwas früheren Aktivierungsstadium eingefroren und andere in einem fortgeschritteneren Stadium.“
Dieses „Schnelleinfrieren“ kann nach der Aktivierung zu unterschiedlichen Zeitpunkten wiederholt werden. Die so gewonnenen Bilder ermöglichen es den Forschern, den Prozess Schritt für Schritt auf atomarer Ebene zu rekonstruieren.
„In unserer Arbeit konzentrieren wir uns hauptsächlich auf Veränderungen in der räumlichen Struktur des G-Proteins, die nach der Bindung des Medikaments an den β2-adrenergen Rezeptor ausgelöst werden“, erklärt Gmeiner. Seine Gruppe trug maßgeblich zum Erfolg des Projekts bei: Es gelang ihnen, eine Art „Super-Adrenalin“ zu entwickeln, das besonders gut an den β2-Rezeptor bindet.
„Diese starke Bindung stabilisiert den Komplex aus Rezeptor und G-Protein“, erklärt der FAU-Wissenschaftler. Normalerweise fällt diese Aufgabe Proteinen zu, die als Adapterproteine bezeichnet werden. Sie wirken wie molekularer Kaugummi und halten den Komplex zusammen.
„Allerdings machen sie ihre Aufgabe so gut, dass im kryogenen Elektronenmikroskop keine Zwischenschritte sichtbar sind“, sagt Gmeiner. Dank seines „Super-Adrenalins“ konnten Forscher auf Adapterproteine verzichten. Ohne sie ist der Rezeptor-G-Proteinkomplex ausreichend stabil.
„Erst dann konnten wir die Bewegung sichtbar machen“, ergänzt Gmeiner.
Die Ergebnisse könnten die Entwicklung neuer Medikamente erleichtern, und zwar nicht nur solcher, die eine Wirkung auf β2-adrenerge Rezeptoren haben. GPCRs werden eine zentrale Rolle bei der Bekämpfung von Krankheiten zugeschrieben. Fast ein Drittel der derzeit zugelassenen Medikamente beeinflussen die Funktion dieser Rezeptoren, indem sie beispielsweise die Signalübertragung an Zellen verstärken oder schwächen. Zeitaufgelöste kryogene Elektronenmikroskopie soll die Entwicklung besonders wirksamer Medikamente ermöglichen, die auf einen bestimmten Bedarf zugeschnitten sind und daher weniger Nebenwirkungen aufweisen, hofft Gmeiner.
Dafür ist es wichtig, dass die Forscher die molekularen Prozesse der Rezeptoren und ihrer G-Proteine vollständig verstehen. Wie wichtig das ist, zeigt der Nobelpreis, den Brian Kobilka, einer der am aktuellen Programm beteiligten Forscher, vor einigen Jahren erhielt das ist. Er war der erste, der die dreidimensionale Struktur eines GPCR mittels Röntgenkristallographie auf atomarer Ebene und in drei verschiedenen Zuständen bestimmte. Bei diesen Experimenten kam auch ein maßgeschneidertes Medikament zum Einsatz, das im Labor von Peter Gmeiner entwickelt wurde.
Mehr Informationen:
Makaía M. Papasergi-Scott et al., Zeitaufgelöste Kryo-EM der G-Protein-Aktivierung durch einen GPCR, Natur (2024). DOI: 10.1038/s41586-024-07153-1
Bereitgestellt von der Friedrich-Alexander-Universität Erlangen-Nürnberg
Zitat: Forscher „filmen“ die Aktivierung eines wichtigen Rezeptors (13. März 2024), abgerufen am 13. März 2024 von https://phys.org/news/2024-03-important-receptor.html
Dieses Dokument unterliegt dem Urheberrecht. Mit Ausnahme der fairen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient lediglich der Information.