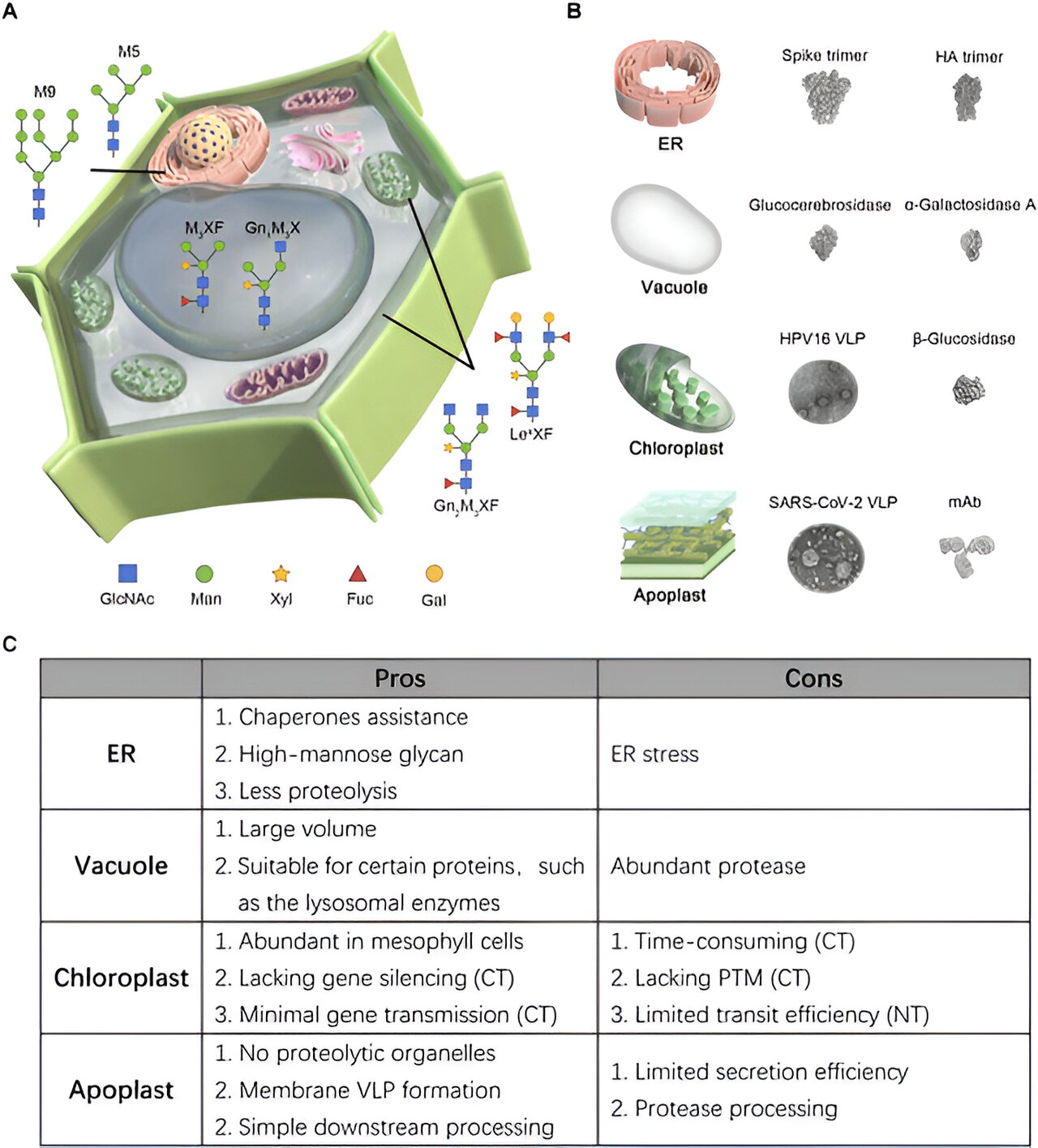
Repräsentative Proteine und ihre vorherrschenden Glykosylierungsmuster, die mit bestimmten subzellulären Kompartimenten assoziiert sind, sowie Vor- und Nachteile. Kredit : BioDesign-Forschung (2024). DOI: 10.34133/bdr.0047
Pflanzenmolekulare Landwirtschaft (PMF) ist eine moderne und hochentwickelte Technologie, die die Biosynthesemaschinerie von Pflanzen nutzt, um eine Vielzahl rekombinanter Proteine, einschließlich industrieller und therapeutischer Enzyme, zu synthetisieren. Es bietet mehrere Vorteile gegenüber herkömmlichen Ansätzen wie der mikrobiellen Fermentation und der Zellkultur von Säugetieren, darunter geringere Kosten, eine Produktion mit hoher Ausbeute und das Fehlen menschlicher Krankheitserreger und Endotoxine. Pflanzen bieten außerdem eine beträchtliche Flexibilität, die eine personalisierte Proteinproduktion ermöglicht.
Es ist bekannt, dass Tabakarten wie Nicotiana benthamiana und Nicotiana tabacum eine beeinträchtigte Grundimmunität und einen weniger robusten Ribonukleinsäure (RNA)-Stummschaltungsweg aufweisen, der den Abbau fremder RNA als Abwehrmechanismus beinhaltet. Dies, gepaart mit seinem kurzen Lebenszyklus und der hohen Biomasseproduktionskapazität, macht es zur idealen Wahl für die schnelle und effiziente Produktion rekombinanter Proteine.
Trotz dieser vielen Vorteile weist die Produktion dieses Proteins jedoch gewisse Einschränkungen auf. Tabakzellen erfordern eine technische Entwicklung, um die spezifische subzelluläre Lokalisierung jedes rekombinanten Proteins zu ermöglichen.
Obwohl viele Studien die Produktion rekombinanter Proteine in Tabak untersucht haben, war eine eingehende Studie zu subzellulären Lokalisierungsstrategien erforderlich. Eine Rezension veröffentlicht in BioDesign-Forschung befasst sich mit dieser Frage und konzentriert sich auf gezielte Strategien, um rekombinante Proteine in vier subzelluläre Kompartimente zu lenken: das endoplasmatische Retikulum (ER), die Vakuole, den Chloroplasten und den Apoplasten.
Um den Kontext zu verdeutlichen, sagt Dr. Shi-Jian Song, Forscher an der Chinesischen Akademie der Agrarwissenschaften und einer der entsprechenden Autoren dieser Studie: „Die Optimierung der subzellulären Lokalisierung einzelner Zielproteine ist entscheidend für den Erfolg der Proteinsynthese.“ und ihre Verwendung in der pharmakologischen Industrie. »
Das ER ist für die Lokalisierung rekombinanter Proteine bekannt, da es molekulare Chaperone beherbergt, die die Proteinfaltung erleichtern und außerdem das Risiko des Proteinabbaus minimieren. Auf das ER gerichtete Proteine durchlaufen eine homogene Glykosylierung, eine Reaktion, bei der Kohlenhydrate hinzugefügt werden, was für viele therapeutische Proteine essentiell ist. Die Akkumulation rekombinanter Proteine im pflanzlichen ER kann durch den Einbau eines N-terminalen ER-spezifischen Targeting- oder Sekretionssignalpeptids sowie einer C-terminalen Retentionssequenz erreicht werden.
Während Dr. Inhwan Hwang, der andere korrespondierende Autor dieser Studie, die Grenzen der Studie hervorhebt, erwähnt er: „Eine ER-Überlastung könnte ER-Stress verursachen, der in solchen Fällen zu einer erheblichen Verringerung der Proteinausbeute führt.“ » Dies kann vermieden werden, wenn während der Expressionsstufen ein sorgfältiges Management durchgeführt wird.
Die Ergebnisse dieser Studie legen nahe, dass die ER-Lokalisierung für große, komplexe Glykoproteine (Proteine mit gebundenen Kohlenhydraten) optimal ist, die für die Faltung Chaperone benötigen. Diese Glykoproteine haben ein Kohlenhydratmotiv, das an das Stickstoffatom gebunden ist, ähnlich wie Säugetierproteine.
Die Pflanzenvakuole ist ein weiteres essentielles Organell im Tabak und nimmt etwa 80–90 % des Zellvolumens der Tabakblätter ein. Die PMF-Technologie nutzt diese enorme Speicherkapazität zur Lokalisierung rekombinanter Proteine. Vakuoläre Sortiersignale, die orts- oder sequenzspezifisch sein können, sind für das vakuoläre Targeting unerlässlich.
Einen interessanten Aspekt dieser Vakuolen hebt Dr. Hai-Ping Diao hervor: „Proteine können über verschiedene Transportwege in die Vakuole gelangen. Die Rekombination wird durchgeführt, um sicherzustellen, dass das Protein unter Umgehung des Golgi-Apparats direkt vom ER zur Vakuole transportiert wird. »
Einige Proteine neigen aufgrund der Anwesenheit eines abbauenden Enzyms namens Protease auch dazu, in der Vakuole abgebaut zu werden. Daher ist es vorzuziehen, Proteine zu lokalisieren, die gegenüber sauren Umgebungen tolerant sind oder sich natürlicherweise im menschlichen Lysosom befinden.
Die Chloroplasten des Tabakblattgewebes enthalten den höchsten Anteil an nativen Proteinen, was sie zu einem idealen Medium für die Anreicherung großer Mengen rekombinanter Proteine macht. Es gibt zwei Hauptstrategien zur Akkumulation großer Mengen rekombinanter Proteine: Chloroplastentransformation und Kerntransformation.
Die Chloroplastentransformation ermöglicht eine stabile Expression fremder Gene, optimale Proteinfaltungsbedingungen und ein minimales Risiko einer Umweltübertragung. Die Herstellung ertragreicher transgener Pflanzen nach diesem Verfahren ist jedoch aufgrund einiger technischer Herausforderungen schwierig und zeitaufwändig.
Bei der Kerntransformation hingegen wird ein rekombinantes Protein mit einem Chloroplasten-Transitpeptid fusioniert, was eine schnellere Proteinproduktion ermöglicht. Die Studie weist darauf hin, dass die Chloroplastenlokalisierung möglicherweise am besten für Proteine funktioniert, die keine wesentlichen biochemischen Modifikationen erfordern.
Der pflanzliche Apoplast, ein entscheidender Raum zwischen der Zellmembran und der Zellwand in Pflanzenzellen, gilt als hervorragender Ort für die Ansammlung rekombinanter Proteine. Die Anreicherung von Proteinen im Apoplasten vereinfacht zudem die Reinigungsmethode.
Während kleinere rekombinante Proteine direkt aus der apoplastischen Flüssigkeit extrahiert werden können, erfordern große Proteinkomplexe einen herkömmlichen Reinigungsprozess. Rekombinante Proteine können aufgrund der Anwesenheit von Protease im Apoplasten auch eine beeinträchtigte strukturelle Integrität aufweisen. Um diese Komplikation zu vermeiden, wird zunehmend die Koexpression eines Proteaseinhibitors als neue Strategie eingesetzt.
PMF hat das Potenzial, die Produktion rekombinanter Proteine zu revolutionieren. Allerdings bleiben anpassungsfähige Produktionsniveaus, vergleichbare Qualitäten und Kostenprobleme bestehen. Dr. Shi-Jian Song erklärt: „Um den Einsatz transgener Pflanzen in der industriellen Forschung zu standardisieren, ist es wichtig, sich strikt an Protokolle zu halten, das öffentliche Engagement zu verbessern und strenge Sicherheitsprotokolle einzuhalten. »
Die Neugestaltung des Tabakpflanzen-Chassis, einschließlich der Verarbeitung von Proteasen mit geringer Effizienz, der effizienten Ressourcenzuteilung und der Einrichtung eines toxinfreien Pflanzenreaktors kann zu weiteren Fortschritten beitragen. Die letztendliche Kommerzialisierung der Bioproduktion ist ein entscheidendes Zeichen für die MFP-Entwicklung.
Weitere Informationen:
Shi-Jian Song et al., Fortschritte in der Technik der subzellulären Akkumulation für die rekombinante Proteinproduktion in Tabak, BioDesign-Forschung (2024). DOI: 10.34133/bdr.0047
Bereitgestellt von der Nanjing Agricultural University
Zitat: Strategien zur Maximierung der rekombinanten Proteinproduktion in Tabakpflanzen (2024, 25. September), abgerufen am 26. September 2024 von https://phys.org/news/2024-09-strategies-maximizing-recombinant-protein-produktion html
Dieses Dokument unterliegt dem Urheberrecht. Mit Ausnahme der fairen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient ausschließlich Informationszwecken.