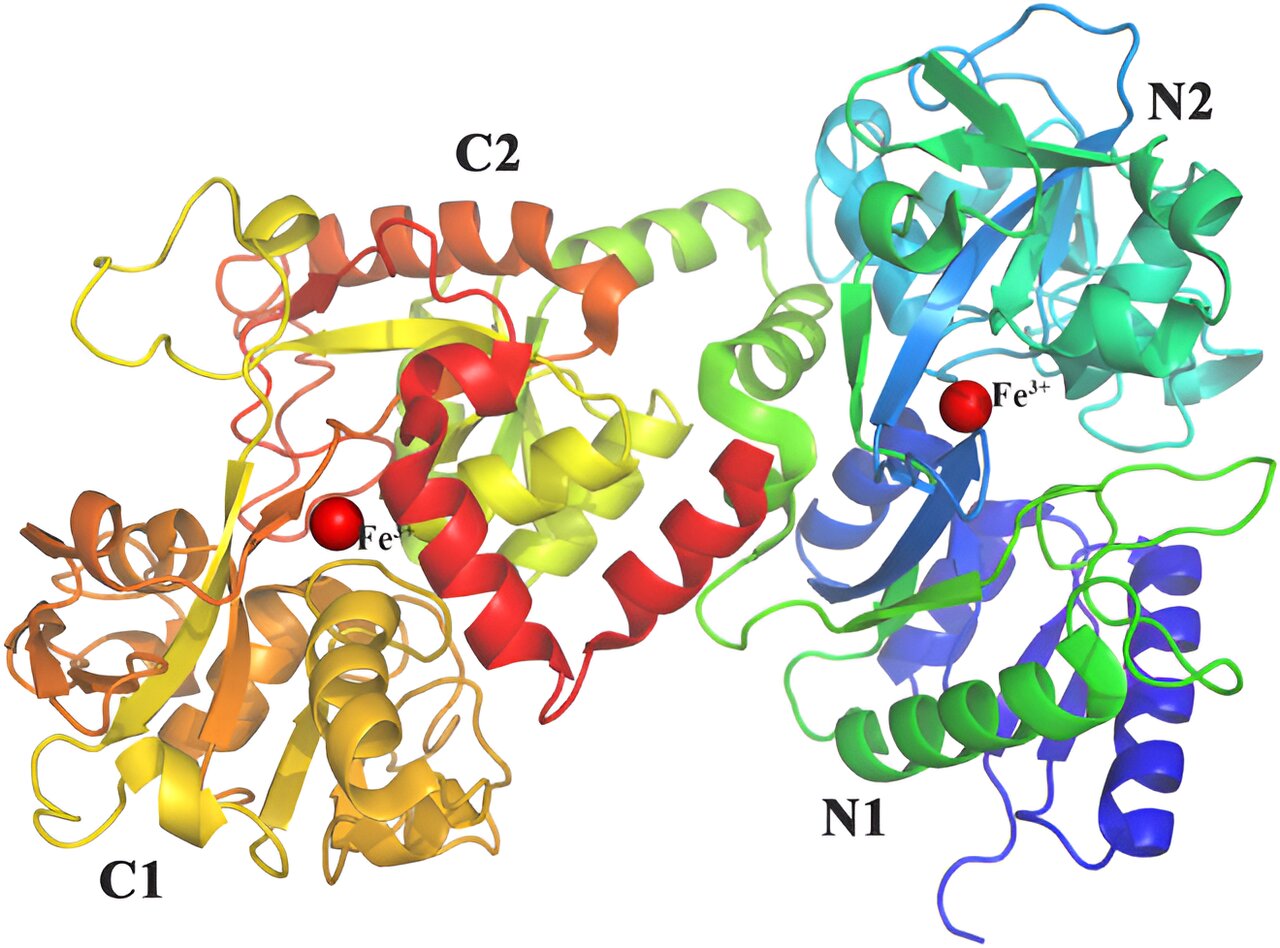
Struktur des menschlichen FL (PDB: 1FCK). Die Tertiärstruktur von LF ist eine Polypeptidkette, die sich entsprechend der Sekundärstruktur faltet, um zwei sehr ähnliche und symmetrische sphärische Blätter zu bilden, nämlich den N-Lappen und den C-Lappen. Die Lappen können in zwei Unterdomänen unterteilt werden (N1 und N2, C1 und C2), die ähnliche Größen haben. Kredit : BioDesign-Forschung (2024). DOI: 10.34133/bdr.0040
Lactoferrin (LF), ein multifunktionales Glykoprotein aus der Transferrinfamilie, kommt natürlicherweise in Muttermilch und Kuhmilch vor. Der Name „LF“ leitet sich von seiner Fähigkeit ab, Eisen zu binden (Ferrin, ein Suffix, das auf ein eisenbindendes Protein hinweist).
FL ist ein wesentlicher bioaktiver Bestandteil der Muttermilch und trägt zur Gesundheit und Entwicklung des Säuglings bei. Aufgrund seiner einzigartigen biologischen Eigenschaften sind Wissenschaftler seit seiner Entdeckung in den 1930er Jahren von FL fasziniert. LF spielt neben anderen biologischen Aktivitäten eine Rolle bei der Immunantwort, der antibakteriellen Aktivität und der entzündungshemmenden Wirkung.
FL trägt zur angeborenen Immunantwort bei und fungiert als erste Verteidigungslinie. Es stört effektiv die Integrität der Zellmembranen und begrenzt die Bakterienvermehrung, indem es die Eisenverfügbarkeit verringert. LF übt auch eine antivirale Aktivität gegen eine Vielzahl von Viren aus.
Darüber hinaus interagiert LF mit Immunzellen wie Makrophagen und Lymphozyten und stimuliert die Immunantwort. Daher bietet LF ein vielfältiges Anwendungsspektrum im Lebensmittel-, Kosmetik- und Pharmabereich.
Allerdings unterliegt die Abtrennung und Reinigung von FL aus Milch gewissen Einschränkungen, so dass es unmöglich ist, die aktuelle Marktnachfrage mit diesem Produkt zu decken. Um diese Herausforderungen zu meistern, haben Forscher neue Technologien entwickelt, die es Mikroorganismen ermöglichen, LF durch Gentechnik zu synthetisieren. Mit der Entwicklung solcher synthetischen biologischen Systeme ist es nun einfacher, Mikroorganismen zur Herstellung großer Mengen FL zu verwenden.
In einer aktuellen Studie, veröffentlicht am 20. August 2024, in BioDesign-ForschungEin Team von Wissenschaftlern unter der Leitung von Dr. Kun Liu von der Anhui Polytechnic University, China, diskutierte den Entwurf und die Konstruktion von LF-Expressionssystemen, einschließlich der damit verbundenen Herausforderungen, Lösungen und Chancen.
„Die Herausforderung, LF für den Marktbedarf zu beschaffen, kann durch die Produktion von LF im industriellen Maßstab mithilfe synthetischer biologischer Expressionssysteme gemeistert werden, da die Struktur von LF, die in diesen Systemen exprimiert wird, der von natürlichem FL sehr ähnlich ist“, erklärt Liu.
Um synthetische LF-Systeme zu erstellen, ist es wichtig, ihre strukturellen Eigenschaften zu kennen. LF hat ein Molekulargewicht von etwa 80 Kilodalton und besteht aus etwa 700 Aminosäuren. Es hat C- und N-terminale Lappen. Der N-terminale Lappen, der thermodynamisch weniger stabil ist, beherbergt die Eisenbindungsstelle. Das Erhöhen oder Hinzufügen zusätzlicher Disulfidbrücken zum N-terminalen Lappen kann die Thermostabilität von LF verbessern.
LF ist ein Protein, dessen Stickstoffatome durch einen Prozess namens N-verknüpfte Glykosylierung an Kohlenhydrate gebunden sind. Die Glykosylierung von LF erhöht die Widerstandsfähigkeit gegenüber enzymatischem Abbau und erhält so seine strukturelle Stabilität. Um eine hohe Stabilität von LF zu erreichen, muss daher ein geeignetes Wirtsexpressionssystem verwendet werden.
In dieser Studie fassten die Forscher die vier synthetischen biologischen Wirtssysteme (Bakterien, Hefen, filamentöse Schimmelpilze und Zelllinien) zusammen, um FL mit hoher Ausbeute zu produzieren. Sie diskutierten auch die Herausforderungen und Lösungen für den Aufbau hocheffizienter LF in diesen Systemen.
In bakteriellen Wirtssystemen ist E. coli das am häufigsten verwendete synthetische biologische System zur LF-Produktion. Das E. coli-System kann 700 mg/L menschliches FL produzieren. Allerdings gibt es gewisse Einschränkungen.
Die Proteinabbauaktivität von E. coli kann LF-Proteine schädigen und dem Bakterienwirt fehlen die für biochemische Veränderungen notwendigen Mechanismen. Darüber hinaus können neu synthetisierte LF-Proteine den Wirt schädigen.
Im Vergleich zum Bakteriensystem sind Hefen und Schimmelpilze eine konkurrenzfähigere Wahl. Beide Wirtssysteme sorgen für eine hohe LF-Expression und können eine biochemische Verarbeitung durchführen, was zur Produktion eines stabileren LF-Proteins führt. Das Haupthindernis bei diesen Systemen besteht jedoch darin, dass neu produziertes LF eine Toxizität für die Systeme verursachen und dadurch seine Expression einschränken kann.
Forscher haben sich darauf konzentriert, die LF-Toxizität während der Fermentation zu reduzieren, um die Proteinexpression zu erhöhen. Das endgültige Wirtssystem, Zelllinien, kann möglicherweise LF synthetisieren, das sowohl in seiner Struktur als auch in seiner Funktion mit natürlichem LF in hohem Maße übereinstimmt.
Zhen Tong, erster Co-Autor, erklärt: „Die größten Herausforderungen von Zellliniensystemen sind ihre hohen Kulturkosten, die Anfälligkeit für Kontaminationen und die Fähigkeit, menschliche Krankheitserreger zu übertragen.“ Darüber hinaus ist der Einsatz von Zelllinien in der FL-Produktion im großen Maßstab noch begrenzt. »
„Es ist wichtig, den Transportmechanismus der Wirtsexpression zu überdenken, um eine schnelle Sekretion von LF zu gewährleisten, das in der extrazellulären Umgebung produziert wird“, sagt Xuanqi Zhang, ebenfalls an der Anhui Polytechnic University tätig, darüber, wie die mit synthetischen biologischen Systemen verbundenen Herausforderungen bewältigt werden können. „Wir sollten auch darüber nachdenken, Schlüsselenzyme zu eliminieren, die FL im Wirt abbauen können. »
Zusammenfassend kann der Einsatz synthetischer biologischer Systeme zur Lösung des Problems der Gewinnung von LF im industriellen Maßstab beitragen. Indem sie die kontrollierte Produktion von LF durch Gentechnik und Wirt-Organismus-Interaktionen ermöglichen, können diese Systeme den Weg für Anwendungen in der Lebensmittel-, Pharma- und anderen Branche ebnen.
Weitere Informationen:
Kun Liu et al, Eine Übersicht: Entwicklung eines synthetischen Lactoferrin-Biologiesystems, BioDesign-Forschung (2024). DOI: 10.34133/bdr.0040
Bereitgestellt von der Nanjing Agricultural University
Zitat: Verbesserung der Lactoferrin-Produktion im industriellen Maßstab mit synthetischen biologischen Systemen (2024, 25. September), abgerufen am 25. September 2024 von https://phys.org/news/2024-09-industrial-scale-lactoferrin-produktion -synthetic.html
Dieses Dokument unterliegt dem Urheberrecht. Mit Ausnahme der fairen Nutzung für private Studien- oder Forschungszwecke darf kein Teil ohne schriftliche Genehmigung reproduziert werden. Der Inhalt dient ausschließlich Informationszwecken.