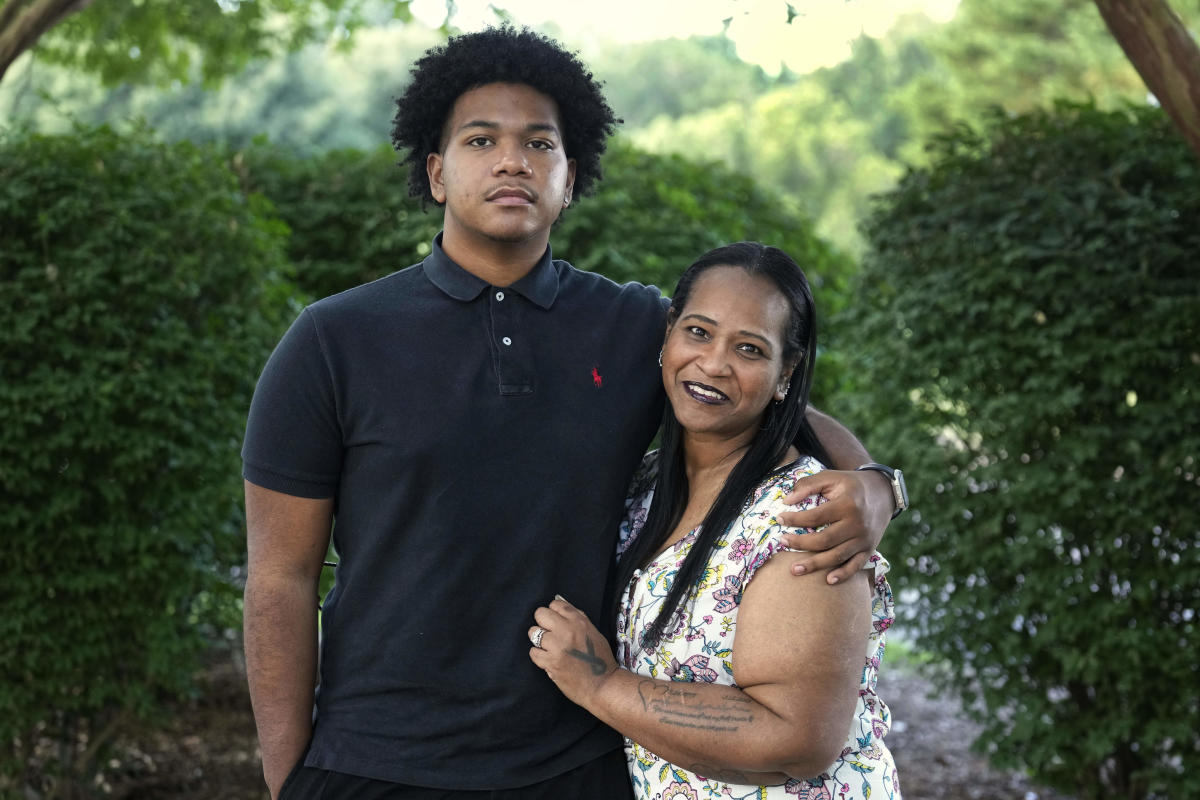Robin Alderman sieht sich einer herzzerreißenden Realität gegenüber: Eine Gentherapie könnte die seltene, erbliche Immunschwäche ihres Sohnes Camden heilen. Doch diese ist ihm nicht zugänglich.
Im Jahr 2022 hörte das in London ansässige Unternehmen Orchard Therapeutics auf, in eine experimentelle Behandlung des Wiskott-Aldrich-Syndroms zu investieren. Und er kann an keinen Gentherapie-Studien teilnehmen.
„Wir haben das Gefühl, die Vergessenen zu sein“, sagte Alderman, die sich seit seiner Kindheit für die Sache ihres 21-jährigen Sohnes einsetzt.
Insgesamt leiden weltweit rund 350 Millionen Menschen an seltenen Krankheiten, von denen die meisten genetisch bedingt sind. Aber jede der 7.000 einzelnen Erkrankungen betrifft vielleicht einige von einer Million Menschen oder sogar weniger. Es gibt wenig kommerziellen Anreiz, diese einmaligen Therapien zu entwickeln oder zu vermarkten, die darauf abzielen, defekte Gene zu reparieren oder durch gesunde zu ersetzen. Dies führt dazu, dass Familien wie Stadträte um Hilfe ringen und einige versuchen, selbst Geld für Heilmittel aufzutreiben, die möglicherweise nie eintreffen.
„Diese Kinder waren zweimal unglücklich: Erstens, weil sie sich eine genetische Krankheit zugezogen haben, und zweitens, weil die Krankheit so selten ist, dass sich niemand darum kümmert“, sagte Dr. Giulio Cossu, Professor für regenerative Forschung an der Universität Manchester England. „Unternehmen wollen Gewinn machen. »
Wissenschaftler sagen, dass diese Dynamik den Fortschritt auf dem neu entstehenden Gebiet der Gentherapie zu vereiteln droht und das Potenzial für eine neue Art von Medizin zunichte macht, ebenso wie ein stetiger Strom von Forschungsarbeiten auf vielversprechende Behandlungsmöglichkeiten für verschiedene Erkrankungen hinweist. Forscher suchen nach Lösungen und wenden sich dabei häufig an Wohltätigkeitsorganisationen, Patientengruppen und Regierungen.
Eine große italienische Wohltätigkeitsorganisation gab im Februar bekannt, dass sie die Wiskott-Aldrich-Behandlung übernehmen würde, die Orchard erhalten hatte. Und ein Zweig der gemeinnützigen Fighting Blindness Foundation half bei der Gründung eines Unternehmens, Opus Genetics, um die Gentherapie-Arbeit unter der Leitung von Dr. Jean Bennett, einem Forscher an der University of Pennsylvania, und einem Kollegen voranzutreiben.
Diese Bemühungen wurden in vielerlei Hinsicht von den Familien der Patienten inspiriert.
„Einige von ihnen bieten Kuchenverkäufe an. „Eine Familie hat ihr Haus verpfändet, um etwas Geld für eine Studie über ihre seltene Krankheit zu spenden“, sagte Bennett. „Ich fühle mich einfach verpflichtet, ihnen zu helfen.“
Der Schmerz der Familien
Die Stadträte waren jahrelang voller Schmerz und Frustration.
Bei Camden Alderman wurde als Baby Wiskott-Aldrich diagnostiziert, verursacht durch ein mutiertes Gen für übermäßige Blutungen.
Als er klein war, wurde ihm aufgrund unkontrollierter Blutungen die Milz entfernt. Als er jung war, landete er mehrmals im Krankenhaus und man sagte ihm, er könne nicht Baseball spielen.
Eine Behandlung ist eine Knochenmarktransplantation. Aber er ist schwarz und hat koreanische Wurzeln, was es schwierig macht, einen Spender zu finden – Menschen passen eher zu jemandem mit ähnlichem Vorfahren oder ähnlichem ethnischen Hintergrund. Robin Alderman erinnert sich an einen Arzt, der sagte: „Im Grunde besteht die einzige Chance auf Heilung für Ihren Sohn in einer Gentherapie.“ »
Er teilte seinen Forschern auch mit, dass sie keine US-Bürger in einer klinischen Studie zulassen würden, was „mir irgendwie das Herz gebrochen hat“, sagte sie.
Heute ist Camden Alderman ein aufstrebender Student an der North Carolina Agricultural and Technical State University. Er nimmt täglich Penicillin und gibt sich wöchentlich Immunglobulin-Infusionen unter die Haut, die bei der Bekämpfung von Infektionen helfen. Allerdings wurde er in den letzten Jahren mehrmals ins Krankenhaus eingeliefert und entwickelte ein Nierenproblem.
Obwohl er die Gentherapie nicht als Allheilmittel ansieht, sagte er: „Sie würde mir nur helfen, ein einfacheres Leben zu führen.“ »
Dies bewahrheitete sich bei Patienten, die sich der experimentellen Therapie unterzogen, wie dem 14-jährigen Sohn von Dr. Priya Stephen, der an einer klinischen Studie in Italien teilnahm, an der damals Amerikaner teilnahmen.
Obwohl Stephen dankbar ist, sagt sie, kann sie nicht umhin, sich schuldig zu fühlen, weil ihrer Familie eine Chance gegeben wurde, die andere nicht haben: „Es ist ethisch einfach inakzeptabel, eine Behandlung zu erhalten, von der wir wissen, dass sie funktioniert, von der wir wissen, dass sie funktioniert.“ sicher, das alle Menschen haben können. Plötzlich kann ich nicht mehr darauf zugreifen.
Eine Zeit lang schien es, als sei die Gentherapie für Wiskott-Aldrich auf dem Weg, breiter verfügbar zu werden. Généthon, eine französische gemeinnützige Forschungsorganisation, hat vielversprechende klinische Studien gesponsert, es fehlten jedoch die Mittel, um die Entwicklung fortzusetzen, sagte ihr CEO Frédéric Revah.
Der Arzneimittelhersteller GlaxoSmithKline hat eine weitere Behandlung zu Orchard verlagert, das 2019 bekannt gab, dass es von der US-amerikanischen Food and Drug Administration eine Zulassung erhalten hat, um die Entwicklung und Prüfung zu beschleunigen. Doch Orchard hat seine Investitionen in diese und zwei andere Behandlungen für seltene Krankheiten vor einigen Jahren eingestellt. CEO Dr. Bobby Gaspar sagte, das Unternehmen habe Mitgefühl mit den betroffenen Familien und werde nach anderen Wegen suchen, um Therapien voranzutreiben.
„Es gibt eine große Anzahl von Krankheiten, die von einer Gentherapie profitieren könnten, für die es jedoch kein Rentabilitätsmodell gibt, weil die Investitionen in die Forschung hoch sind, die Produktionskosten hoch sind und die Zahl der Patienten sehr gering ist“, sagte Revah.
Die meisten genetisch bedingten Krankheiten sind selten und betreffen jeweils weniger als 200.000 Menschen in den Vereinigten Staaten. Bei vielen von ihnen ist die Forschung noch nicht über das Anfangsstadium hinaus fortgeschritten.
Lacey Hendersons Tochter Estella, 5, leidet an alternierender infantiler Hemiplegie, einer neurologischen Erkrankung, von der in den USA 300 Menschen betroffen sind. Estella hat eine kognitive Verzögerung, kann ihre Hände nur eingeschränkt nutzen und ist vorübergehend teilweise oder vollständig gelähmt. » sagte Henderson. Medikamente können die Symptome lindern, eine Heilung gibt es jedoch nicht.
Seine Familie aus Iowa sammelt über GoFundMe und eine Website Geld, um eine Gentherapie zu entwickeln. Sie brachten etwa 200.000 Dollar ein.
„Wir haben drei verschiedene Projekte mit unterschiedlichen Forschern“, sagte Henderson. „Aber das Problem ist, dass alles unterfinanziert ist.“
„Fehlausgerichtete“ Anreize
Finanzielle Fehlanreize belasten den Prozess von der Arzneimittelentdeckung bis zur Entwicklung, sagen Wissenschaftler.
Der Arbeitsaufwand, der erforderlich ist, um vom Labor auf Tests am Menschen und den Arzneimittelzulassungsprozess umzusteigen, sei „unglaublich teuer“, sagte Dr. Donald Kohn, Professor für Mikrobiologie, Immunologie und Molekulargenetik an der University of California, Los Angeles.
In den letzten zwei Jahren seien die Investitionen in die Gentherapie weitgehend zurückgegangen, sagte er.
„Wenn Sie 20 oder 30 Millionen US-Dollar ausgeben müssen, um eine Genehmigung zu erhalten, und Sie fünf oder zehn Patienten pro Jahr haben, ist es schwierig, eine Rendite für Ihre Investition zu erzielen“, sagte Kohn. „Wir haben also wirksame und sichere Therapien, aber es sind eher finanzielle und wirtschaftliche Faktoren, die verhindern, dass sie zugelassene Medikamente werden.“
„Letztendlich gehen die meisten Biotech-Unternehmen an die Börse und müssen sich auf den Aktionärsgewinn konzentrieren“, sagte François Vigneault, CEO des Biotech-Unternehmens Shape Therapeutics in Seattle.
„Das Board steht im Weg; Sie versuchen, ihre Einnahmen zu maximieren“, sagte Herr Vigneault, dessen Unternehmen privat ist. „Es ist nur Gier. Dies ist einfach ein Anreiz, der nicht zur Struktur des Unternehmens passt und nicht zu dem, was wir zum Wohle der Welt tun sollten.
Selbst wenn Behandlungen auf den Markt kommen, bleiben sie möglicherweise nicht dort. Im selben Jahr stellte Orchard die Investitionen in die Wiskott-Aldrich-Behandlung ein und stellte auch den Vertrieb eines Medikaments namens Strimvelis ein, das in Europa zur Behandlung der seltenen Krankheit ADA-SCID oder „Bubble-Boy-Syndrom“ zugelassen war.
„Eine große Herausforderung“
Claire Booth, Professorin für Gentherapie und pädiatrische Immunologie am University College London, gehört zu denen, die auf Veränderungen drängen. Sie ist Mitbegründerin von Access to Gene Therapies for Rare Disease, das Menschen aus ganz Europa zusammenbringt, die akademische Gruppen, Patientenvertreter, Regulierungsbehörden, Geldgeber und Arzneimittelhersteller vertreten. Sie hoffen, eine unabhängige, gemeinnützige Organisation zu gründen, die die Marktzulassung und den Zugang zu Therapien unterstützen kann, die kommerziell nicht nachhaltig sind.
In den Vereinigten Staaten wurde eine ähnliche Initiative, das Bespoke Gene Therapy Consortium, von der National Institutes of Health Foundation organisiert und umfasst die FDA, verschiedene NIH-Institute sowie mehrere Pharmaunternehmen und gemeinnützige Organisationen. Zu den Zielen der Gruppe gehört die Unterstützung einer Handvoll klinischer Studien und die Erforschung von Möglichkeiten zur Rationalisierung regulatorischer Prozesse.
Einige Forscher versuchen, das Problem wissenschaftlich zu lösen. Dr. Anna Greka sagte, das Broad Institute of MIT und Harvard habe eine Anstrengung gestartet, um die Gemeinsamkeiten hinter verschiedenen Bedingungen zu untersuchen – oder Knoten, die man sich als an einem Baumstamm zusammentreffende Äste vorstellen kann. Die Reparatur der Knoten mithilfe von Gentherapien oder anderen Behandlungen anstelle bestimmter „Rechtschreibfehler“ in der DNA, die eine Störung verursachen, könnte mehrere Krankheiten gleichzeitig behandeln.
„Dadurch erhöht sich die Zahl der Patienten, die von der Therapie profitieren können“, sagte Broad-Mitglied Greka. „Außerdem wird es für jeden, wie zum Beispiel ein biopharmazeutisches Unternehmen, unendlich einfacher und attraktiver, das Projekt voranzutreiben und zu versuchen, es in die Klinik zu bringen, weil sie einen größeren Markt haben werden.“
In der Zwischenzeit arbeiten betroffene Familien untereinander und mit Wissenschaftlern zusammen, um dabei zu helfen, die Nadel zu bewegen. Généthon wurde von einer Vereinigung von Patienten und ihren Angehörigen gegründet, um Behandlungen gegen mehrere seltene Krankheiten zu entwickeln. Und ein Stiftungsmanager, der an Opus Genetics beteiligt ist, hat ein Kind mit einer seltenen genetischen Netzhauterkrankung.
Es gibt auch neue Hoffnung für Familien, die an der Wiskott-Aldrich- und Bubble-Boy-Krankheit leiden. Letztes Jahr übernahm die Telethon Foundation in Italien die Verantwortung für die Produktion und den Vertrieb von Strimvelis. In diesem Jahr gab die Wohltätigkeitsorganisation bekannt, dass sie für ein Pilotprogramm der Europäischen Arzneimittel-Agentur ausgewählt wurde, das dabei helfen könnte, ihre Wiskott-Aldrich-Gentherapie durch den Regulierungsprozess zu führen.
Wissenschaftler sagen jedoch, dass diese Bemühungen das umfassendere finanzielle Dilemma bei Therapien für seltene Krankheiten nicht beseitigen und es möglicherweise einige Zeit dauern wird, bis solche genetischen Behandlungen Patienten auf der ganzen Welt zur Verfügung stehen.
„Es ist eine riesige Herausforderung, und ich bin nicht ganz sicher, ob wir sie meistern können“, sagte Booth. „Aber wir müssen ein Risiko eingehen, denn wir haben Jahrzehnte und Millionen in die Entwicklung dieser transformativen Behandlungen investiert. Und wenn wir es nicht versuchen, fühlt es sich an wie das Ende einer Ära. »
____
Die Gesundheits- und Wissenschaftsabteilung von Associated Press erhält Unterstützung von der Science and Education Media Group des Howard Hughes Medical Institute. Für sämtliche Inhalte ist allein der AP verantwortlich.